2021.06.03.7
Files > Volume 6 > Vol 6 No 3 2021
INVESTIGATION / RESEARCH
Trametes coccinea IDEA, un hongo súper productor de lacasas aislado de un lago natural de asfalto: Tolerancia y biotransformación de hidrocarburos policíclicos aromáticos
Trametes coccinea IDEA, a super laccases-producer fungus isolated from a natural asphalt lake: Tolerance and biotransformation of aromatics polycyclic hydrocarbons
Beatriz Pernía1,2*, Hector Urbina1,3, Meralys González1, Lucia Sena1, Yanet Villasana4, Leopoldo Naranjo-Briceño1,5
Available from: http://dx.doi.org/10.21931/RB/2021.06.03.7
RESUMEN
Los hidrocarburos policíclicos aromáticos (HPAs) son compuestos tóxicos que no se degradan fácilmente bajo condiciones naturales tales como fenómenos físicos (fotooxidación, volatilización), químicos (intercambio iónico, complejación, transformación) y biológicos (degradación por microorganismos autóctonos) que además, dependen de la temperatura, humedad y niveles de oxígeno. El objetivo del presente trabajo fue aislar, identificar y caracterizar fenotípicamente hongos hidrocarbonoclásticos de ambientes extremos que sean capaces de tolerar HPAs, tales como Trametes coccinea IDEA, que se aisló del Lago de asfalto natural de Guanoco en Venezuela. A fin de estudiar su tolerancia a los HPAs, el hongo se expuso a diferentes concentraciones de naftaleno, fenantreno y pireno (0, 2.5, 25, 50, 100, 200, 400, 800 y 1600 mg/L). Posteriormente, en ensayo en medio de cultivo líquido, se procedió a estudiar el efecto de los HPAs sobre la actividad de enzimas del sistema enzimático de degradación de lignina (SEDL), así como sobre la posible variación en los niveles de toxicidad empleando Lactuca sativa como bioindicador. Los resultados mostraron una mayor tolerancia al pireno, seguido por el naftaleno y fenantreno. Se observó una fuerte inducción de la actividad lacasa en presencia de naftaleno (167.96 U/mgP) y pireno (124.89 U/mgP) con respecto al control, mientras que con fenantreno se obtuvo una baja actividad (88.67 U/mgP). De manera interesante, se evidenció una generación de sub-productos más tóxicos cuando el naftaleno y el fenantreno fueron biotratados por el hongo, mientras que el nivel de toxicidad del pireno disminuyó significativamente. T. coccinea IDEA tiene un alto potencial para ser utilizado en estrategias de biorremediación de hidrocarburos, las cuales deben ser monitoreadas mediante análisis ecotoxicológicos para detectar posibles variaciones de toxicidad de los productos parcialmente biotransformados.
Palabras clave: micorremediación, biotransformación, ecotoxicidad, HPAs
ABSTRACT
Polycyclic aromatic hydrocarbons (HPAs) are toxic compounds that are not easily degraded under natural conditions. The goal of the present study was to isolate, identify and phenotypically characterize hydrocarbonoclastic fungi from extreme environments that are capable of tolerating HPAs, such as Trametes coccinea IDEA, that was isolated from the Natural Asphalt Lake of Guanoco in Venezuela. To study its tolerance to HPAs, the fungus was exposed to different concentrations of naphthalene, phenanthrene, and pyrene (0, 2.5, 25, 50, 100, 200, 400, 800, and 1600 mg/L). Subsequently, in a test in a liquid culture medium, the effect of these HPAs on the activity of enzymes of the lignin-degrading enzymes system (LDES) was studied, and the possible variations in toxicity levels using Lactuca sativa as bioindicator. The results showed a high tolerance to pyrene, followed by naphthalene and phenanthrene. Strong induction of laccase activity was observed at the presence of naphthalene (167.96 U/mgP) and pyrene (124.89 U/mgP) compared with the control, while with phenanthrene a low activity was obtained (88.67 U/mgP). Interestingly, a generation of more toxic byproducts was observed when naphthalene and phenanthrene were biotreated by the fungus, while the toxicity level of pyrene decreased significantly. T. coccinea IDEA has a high potential to be used in hydrocarbon bioremediation strategies, which must be monitored by ecotoxicological analysis to detect the possible toxicity levels variations in the partially biotransformed products.
Keywords: mycoremediation, biotransformation, ecotoxicity, PAHs
INTRODUCCIÓN
Los hidrocarburos policiclicos aromáticos (HPAs) son compuestos de origen natural y antropogénico, que se encuentran en el suelo, el aire y el agua. De estos compuestos, 16 han sido considerados por la Environmental Protection Agency (EPA) como tóxicos, recalcitrantes y cancerígenos 1,2. Además, estos compuestos no se degradan fácilmente bajo condiciones naturales y su persistencia en el ambiente incrementa al aumentar su peso molecular. Se ha reportado que los HPAs se encuentran en todos los componentes del medio ambiente y se bioacumulan en los organismos 3.
Es por ello, que se han sumado esfuerzos para encontrar organismos que sean capaces de tolerar y degradar estos compuestos con la finalidad de emplearlos en nuevas estrategias biotecnológicas de saneamiento ambiental. La biorremediación emplea organismos para degradar, detoxificar o biotransformar compuestos tóxicos y convertirlos en menos tóxicos o inocuos 4. Dentro de dichos organismos, se ha demostrado que los hongos cuentan con un sistema enzimático de degradación de lignina (SEDL) que, por su baja especificidad de sustrato, es capaz de biotransformar eficientemente HPAs5. Dentro del grupo de hongos, los hidrocarbonoclásticos extremófilos surgen como un grupo heterogéneo que vive de manera óptima en condiciones extremas y tiene una alta capacidad de usar hidrocarburos como única fuente de carbono y energía 5.
En este sentido, existen algunas especies de hongos capaces de tolerar y degradar estos hidrocarburos puesto que producen extracelularmente enzimas que catalizan reacciones oxidativas. Entre las enzimas con alto potencial en biocatálisis ambiental, han sido reportadas la citocromo P-450 6, la lignina peroxidasa (LigP)7, la manganeso peroxidasa (MnP)8,9, la cloroperoxidasa 10, la lacasa (Lac)11 y las benzopireno hidroxilasa 12.
Dentro de éstas exoenzimas oxidativas, se destacan las lacasas (EC 1.10.3.2), las cuales son enzimas glicosiladas, multicobre, cuya función es catalizar la oxidación de compuestos fenólicos, polifenólicos y aminas aromáticas, mediante el acoplamiento con la reducción de oxígeno a agua 13. Sin embargo, esta enzima presenta una amplia inespecificidad de sustrato, por lo que puede oxidar una gran variedad de compuestos, tales como colorantes, pesticidas, disrruptores endocrinos e HPAs 14. La lacasa ha sido utilizada a nivel industrial para el análisis de drogas, el blanqueamiento en la industria papelera y textil, la síntesis de polímeros y en procesos de biorremediación y saneamiento de aguas residuales 15. En el caso de los HPAs, se ha reportado que esta enzima es capaz de oxidar naftaleno, fenantreno, antraceno, benzopireno, 9 metilantraceno y 2 metilantraceno 16.
Sin embargo, aunque estas enzimas son capaces de degradar hidrocarburos, en algunos casos, en el proceso de biotransformación se podrían generar compuestos más tóxicos que los HPAs originales, por lo que deben realizarse pruebas de ecotoxicología a fin de verificar la posible generación de compuestos más tóxicos que el contaminante original 17.
En la búsqueda de hongos que sean capaces de sintetizar estas enzimas para su uso potencial en procesos de degradación de hidrocarburos, se han aislado hongos de ambientes extremos, tales como el caso del Lago de Asfalto de Guanoco, ubicado en el estado Sucre en Venezuela 18. Este lago de asfalto tiene una superficie de 420 hectáreas, presenta una baja concentración de nutrientes debido a que está conformado casi en su totalidad por asfalto y se caracteriza por contener 83% carbono, 11% hidrógeno y 6% azufre 19.
En la presente investigación se aisló del Lago de Asfalto de Guanoco el hongo Trametes coccinea, el cual es un hongo de pudrición blanca, capaz de producir a nivel extracelular enzimas tales como celobiohidrolasas, glucanohidrolasas, β- glucosidasas, xilanasas, α-amilasa, lignina peroxidasa, manganeso peroxidasa, fenoloxidasa 20,21 y, adicionalmente, sintetiza grandes cantidades de la enzima lacasa 22. También, se ha descrito que este hongo es capaz de degradar antraceno (67.5%), pireno (31.1%) 23, fenantreno (45.6%) y benzo[a]antraceno (90.1%) en 14 días a una temperatura de 28°C 24.
Los objetivos principales de este trabajo fueron: i) aislar e identificar un hongo con alta capacidad de degradar HPAs del Lago de Asfalto de Guanoco, ii) determinar la tolerancia del hongo a distintas concentraciones de HPAs, iii) identificar cambios en la actividad de las enzimas lacasas ante su exposición a distintos HPAs, y iv) analizar la variación en la toxicidad de los HPAs tras su biotransformación por el hongo.
MATERIALES Y MÉTODOS
Aislamiento, caracterización taxonómica e identificación molecular
Un hongo Basidiomycota de identificación desconocida, el cual fue adoptado en nuestro Laboratorio de Petromicrobiología como el Soldado Desconocido, fue aislado de una raíz de una dicotiledónea que se encontraban inmersa en medio del Lago natural de Asfalto de Guanoco, ubicado en el estado Sucre en Venezuela, al Norte de América del Sur (Figura 1). La raíz se colocó en una bolsa plástica en oscuridad y fue conservada en el laboratorio a +4oC. A los tres meses apareció el basidiocarpo creciendo sobre la raíz del árbol (Figura 2A).
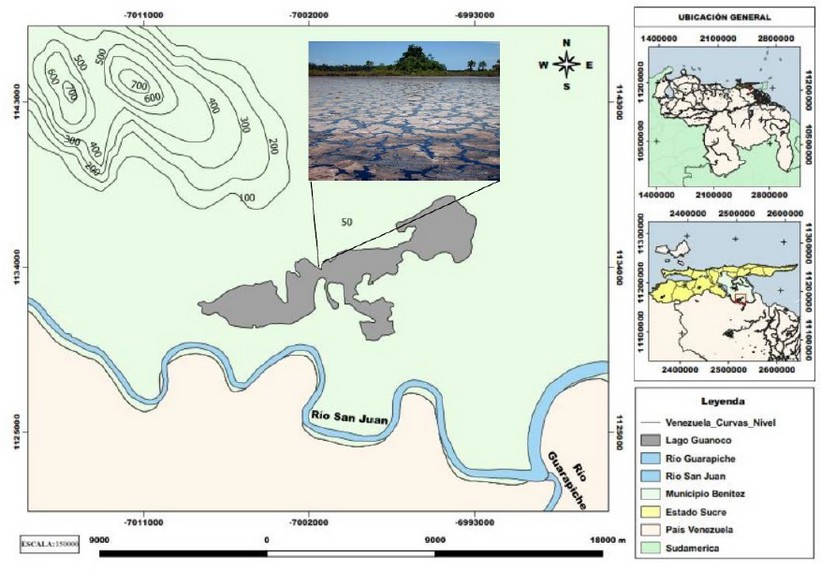
Figura 1. Localización espacial de Lago de Asfalto de Guanoco.
Para su aislamiento, se seccionó un trozo del contexto del hongo en condiciones de esterilidad y se sembró en placas con medio Power 25 donde, tras sucesivos repiques, se obtuvo un cultivo axénico (Figura 2B).
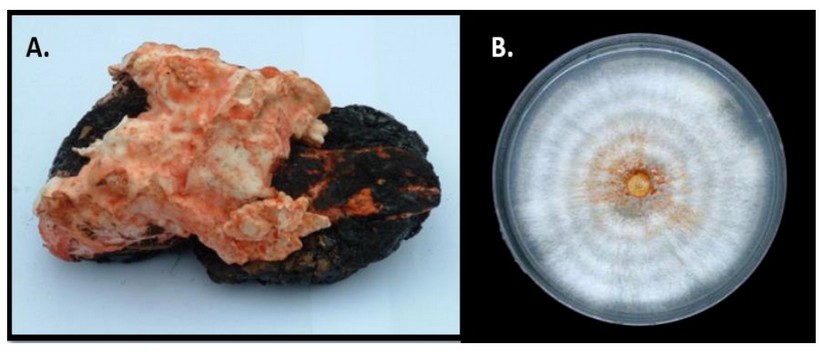
Figura 2. Soldado Desconocido creciendo en una raíz de dicotiledónea inmersa en el Lago natural de Asfalto de Guanoco (A). Cultivo axénico del Soldado Desconocido en medio Power (B).
La identificación taxonómica se realizó mediante la caracterización de su morfología macro y microscópica (color del basidiocarpo, hifas, conidias, clamidosporas, conidióforos y células conidiogénicas). La información fue recopilada en una descripción y se comparó con la literatura especializada.
La identificación molecular de este organismo se realizó inoculando esporas en medio MPPY según la metodología propuesta por Montenegro et al. 26 y Naranjo et al. 27 y fueron incubadas en un agitador a 30°C y 250 rpm durante 48 h. Posteriormente, el micelio fue recuperado por filtración utilizando un filtro Nytal, se lavó dos veces con NaCl al 0.9% (P/V), se congeló con nitrógeno líquido y se almacenó a -80°C. Luego, se tomaron 300-500 mg de micelio, se pulverizó con nitrógeno líquido y se añadieron 1 mL de tampón de rotura (0.18 M Tris/HCl pH 8.2, 10 mM EDTA, 1% SDS) y 1 mL de fenol, se incubó por 30 min a 50°C con agitación en Vórtex cada 5 min. Luego, se extrajo el ADN genómico con fenol/CIA (fenol:cloroformo:alcohol isoamílico, 25:24:1) y se repitió este procedimiento hasta que la interface quedó limpia. El ADN genómico fue precipitado con 2.5 vol de etanol y 0.1 vol de 3M acetato de sodio (pH 3.2) y se conservó durante la noche a -20 oC. Al día siguiente, la muestra se centrifugó a 14.000 rpm a RT, se hizo un lavado con ETOH al 70% y el ADN se resuspendió en buffer Tris-EDTA (TE) 28.
Para la identificación molecular se amplificó por PCR la región 26S rRNA, utilizando los cebadores: NL1(sentido): 5’…GCATATCAATAAGCGGAGGAAA AG…3’ y NL4 (antisentido): 5’…GGTCCGTGTTTCAAGACGG…3’. Las reacciones de PCR se llevaron a cabo en un termociclador Applied Biosystems 2720 empleando una concentración final de los deoxiribonucleotidos trifosfatos (dNTP’s) de 0.25 mM y 100-250 ng de ADN genómico como molde. Las condiciones de PCR fueron las siguientes: i) pre-desnaturalización a 95°C por 5 min, seguidos por 30 ciclos de ii) desnaturalización a 95°C por 5 min, iii) anillamiento a 52°C por 30 s, iv) extensión a 72°C por 1 min y, v) una extensión final a 72°C por 7 min.
El producto de PCR obtenido (600 pb) fue doblemente purificado utilizando el kit de purificación Wizard Genomic DNA Purification Kit Promega (Madison, WI). Posteriormente, las muestras de ADN fueron enviadas a secuenciar en UC Berkeley DNA Sequencing Facility (California, USA). El análisis in silico de las secuencias de nucleótidos se realizó utilizando los programas DNASTAR Programs (DNASTAR, Inc., UK), BLASTN 29 utilizando formato FASTA 30.
Prueba de tolerancia del hongo a los HPAs en medio sólido BSM
Para determinar la tolerancia del hongo a los HPAs, en principio, se utilizó como base el medio salino básico (BSM) 31. Los HPAs se diluyeron inicialmente en una mezcla de 20 ml de acetona/ tween 80/agua y se ajustaron a las siguientes concentraciones: 12.5, 25, 50, 100, 200, 400, 800 y 1600 mg/L en medio BSM. Cada 24 horas y durante 8 días, se realizaron mediciones del diámetro de las colonias con un vernier calibrado a fin de determinar su tasa de crecimiento.
Índice de Tolerancia
El índice de tolerancia (IT) se determinó a los 8 días de incubación del hongo con los diferentes HPAs a 30°C, mediante la siguiente ecuación:
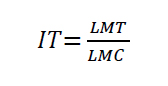
Donde:
LMt = es la longitud del micelio tratado con los HPAs.
LRc = es la longitud del micelio control.
Prueba de tolerancia del hongo a los HPAs en medio líquido BSM
Una vez conocida la concentración mínima inhibitoria de HPAs que no afectaba el crecimiento del hongo, se inocularon 95 ml de medio BSM con 20x104 esporas de T. coccinea y se incubaron a 30ºC por 7 días. Al día 7 se procedió a añadir 5 mg/L de cada uno de los HPAs (naftaleno, fenantreno y pireno) diluidos en una mezcla tween-acetona con un volumen final de 100 ml. Se utilizó como control el hongo en medio BSM con el diluente tween-acetona. Todos los experimentos se realizaron por triplicado. Se tomaron muestras a los días 0, 1, 3 y 5.
Efecto de los HPAs sobre la actividad enzimática de las enzimas extracelulares guaiacol peroxidasa, lignina peroxidasa, manganeso peroxidasa y lacasa
Para determinar la actividad de la guaiacol peroxidasa se utilizó la metodología de Fielding y Hall (1978) citada por Chaoui et al. 32. La actividad de la enzima se determinó siguiendo el incremento en la absorbancia a 470 nm por la polimerización del Guaiacol. Utilizando el coeficiente de extinción molar (26.6/mM x cm) se llevaron a unidades de enzima por g de peso fresco, definiéndose una unidad de enzima como la cantidad de enzima que produce 1 µmol de tetraguaiacol en 1 min a 25°C. Para llevar a cabo la reacción, se mezcló 25 mM de buffer fosfato (pH 7) con 10 mM de H2O2, 9 mM de guaiacol y 25 µl del cultivo enzimático.
La actividad de la LiP se midió siguiendo la metodología propuesta por Troller et al. 33 y fue analizada mediante la oxidación del alcohol veratrílico en una mezcla de reacción que contenía: alcohol veratrílico (20 mM) en un buffer 0.5 M de fosfato de sodio (pH 3.0), como agente oxidante peróxido de hidrógeno al 30 % y 0.025 mL del cultivo enzimático. La oxidación del alcohol veratrílico fue monitoreada de 0-200 s por medio del incremento de la absorbancia a 310 nm. La unidad de actividad enzimática (U) se definió como: 1 μM alcohol veratrílico oxidado por mL de sobrenadante en un min (ε310 = 9.3 mM-1.cm-1)
La actividad de la MnP se determinó según la metodología propuesta por Papinutti et al. 34 y fue analizada por medio de la oxidación del rojo de fenol, en una mezcla de reacción constituida por: 0.1 mL de rojo de fenol (0.1 %) en un buffer 0.5 M de fosfato de sodio (pH 5.0), cofactor 0.1 mL de sulfato de manganeso (1 mM) y 0.04 mL del cultivo enzimático. La oxidación del rojo de fenol fue monitoreada de 0-200 s por medio del incremento de la absorbancia a 610 nm. La unidad de actividad enzimática (U) se definió como: 1 μM rojo de fenol oxidado por mL de sobrenadante en un min (ε610 = 22.0 mM-1.cm-1).
La actividad de la Lac fue determinada según la metodología propuesta por Saparrat et al. 35 siguiendo la oxidación del ABTS en una mezcla de reacción constituida por: 0.01 mL de ABTS (25 mM) en un buffer 0.1 M de tartrato de sodio (pH 5.0) y 0.1 mL del cultivo enzimático. La oxidación del ABTS fue monitoreada de 0-200 s por medio del incremento de la absorbancia a 436 nm. La unidad de actividad enzimática (U) se definió como: 1 μM ABTS oxidado.
Estimación de proteínas totales
La concentración de proteínas se estimó en el sobrenadante utilizando el método de Bradford 36 y como estándar BSA.
Actividad de la enzima lacasa en un zimograma
Para observar la actividad de las isoenzimas de la lacasa por separado, se corrió un gel PAGE al 12 % bajo condiciones no denaturalizantes y, posteriormente, se fijó por 10 min con una solución 30% metanol y 10% ácido acético. El gel se incubó en una solución que contenía 5 mM de ABTS en buffer tartrato 0.5 M pH 5.0. Finalmente, se tiño el gel con azul de coomasie para verificar el peso molecular de las isoenzimas y para confirmar que la diferencia en la actividad no era debido a la concentración de la enzima sino a su activación por los HPAs.
Actividad de enzimas peroxidasas en gel
Para observar la actividad de las enzimas peroxidasas se utilizó el mismo protocolo anterior para el ABTS sólo que en este caso, en vez de ABTS, se utilizó 5 mM de Guaicol y 10 mM de H202.
Ensayos de toxicidad empleando Lactuca sativa como bioindicador
A fin de determinar variaciones en la toxicidad de los compuestos antes y después de haber sido biotratados con el hongo, se practicó una prueba de toxicidad según el protocolo propuesto por la USEPA EPA 00/3-88-029. En primer lugar, se estandarizó la concentración de medio de cultivo a utilizar, partiendo de la premisa de utilizar una dilución a la cual ni el medio de cultivo BSM ni el medio BSM en presencia del hongo fuese tóxico. En pruebas previas se determinó que la dilución óptima del sobrenadante era 1:15. Todos los extractos se conservaron durante la noche a -20°C previo a los ensayos con el fin de inactivar las enzimas ligninolíticas. Se calculó el Índice Integral de Fitotoxicidad (IIF) utilizando la fórmula propuesta por Pernía et al. 17:
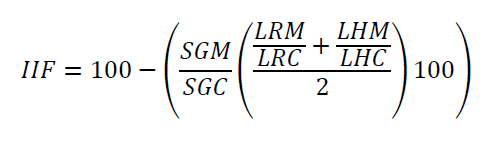
Donde:
SGM = número de semillas germinadas de la muestra, es el promedio del número de semillas germinadas en las cuatro réplicas para cada tratamiento (n = 4).
SGC = número de semillas germinadas del control, es el promedio del número de semillas germinadas en las cuatro réplicas del testigo (n = 4).
LRM = Longitud de la radícula de la muestra, es el promedio de la medición en centímetros de las radículas de 10 plántulas por réplica de cada tratamiento (n = 40).
LRC = Longitud de la radícula del control, es el promedio de la medición en centímetros de las radículas de 10 plántulas por réplica del testigo (n = 40).
LHM = Longitud del hipocótilo de la muestra, es el promedio de la medición en centímetros de los hipocótilos de 10 plántulas por réplica de cada tratamiento (n = 40).
LHC = Longitud del hipocótilo del control, es el promedio de la medición en centímetros de los hipocótilos de 10 plántulas por réplica del testigo (n = 40).
Este índice muestra los resultados de -100 a +100 pudiéndose interpretar en términos de porcentaje. También permite observar no solo los efectos de inhibición de crecimiento (valores positivos), sino también los efectos de estimulación de crecimiento (valores negativos).
Análisis estadísticos
Para el análisis estadístico se aplicó una prueba de Anderson-Darling para verificar la distribución normal de los datos. Con la finalidad de analizar la homocedasticidad de los tratamientos se aplicó una prueba de Levene. Para comparar entre las medias de crecimiento, concentración de proteínas, actividad enzimática y crecimiento de las plántulas se aplicó una prueba ANOVA de una vía con test a posteriori de Dunnet o Tukey (p<0.05). Todas las pruebas estadísticas se realizaron con el programa Minitab versión 19.
RESULTADOS
La caracterización taxonómica y la identificación molecular del Soldado Desconocido determinaron que pertenece a la especie Trametes coccinea
El hongo Basidiomycota creciendo en una raíz de una dicotiledónea fue exitosamente aislado a partir de su micelio aéreo. La descripción taxonómica del Soldado Desconocido fue la siguiente: colonias blancuzcas cuando están jóvenes y a medida que maduran se tornan amarillentas con pigmentación anaranjada, crecen de forma zonada, superficial y con borde entero, algodonosas y superficiales (Figura 2B). Conidiogénesis tretrica, enteroblástica, baxautica. Las hifas son hialinas, de pared delgada y lisa, con fíbulas ramificadas. Los conidióforos no están diferenciados. Conidios hialinos, cilíndricos a globosos, algunos con una ligera constricción central, con extremos truncados cuando recién están escindidos de las hifas y con extremos redondeados cuando están maduros, de pared delgada y lisa, sin gútulas, aseptados, excisión esquizolítica. Clamidiosporas hialinas, obclavadas, solitarias, terminales a intercalares, algunas con un extremo truncado, de pared engrosada y lisa. Basidiocarpo, constituido por hifas esqueléticas, hialinas, y sin septos (Figura 3).
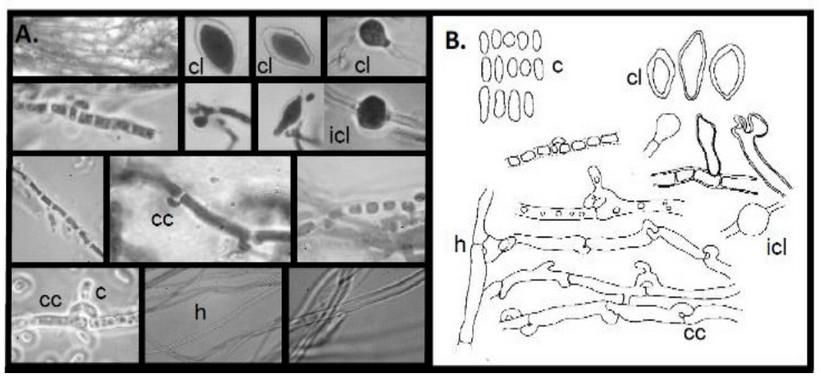
Figura 3. Fotografía y dibujos del Soldado Desconocido en medio de cultivo (A). Conidias (c), hifas productoras de conidias, clamidosporas (cl), clamidosporas intercalares (icl), fíbulas (cc) e hifas (h) en microscopio óptico1000X (B).

Figura 4. Porcentaje de tolerancia e inhibición del crecimiento del hongo T. coccinea en medio sólido BSM expuesto a distintas concentraciones de HPAs. Naftaleno (A), Fenantreno (B), Pireno (C). Las barras y puntos representan la media ± desviación estándar (n=3). Letras iguales señalan que no hay diferencias estadísticamente significativas según ANOVA de 1-vía p<0.05 y test a posteriori de Tukey.
La caracterización taxonómica y la identificación molecular permitieron determinar que el Soldado Desconocido pertenecía a la especie Pycnoporus sanguineus (L.) Murrill 1904, Polyporaceae, el cual actualmente ha sido re-clasificado como Trametes coccinea (Fr.) según Li y He 38.
Tolerancia de T. coccinea a los HPAs estudiados
Los resultados mostraron que T. coccinea tiene tolerancia al naftaleno y al pireno, a excepción del fenantreno el cual fue tóxico para el hongo a bajas concentraciones. En cuanto al naftaleno pudimos observar un efecto tóxico a partir de 800 mg/L, donde el índice de tolerancia se redujo a 0.77 y 0.60 a 800 y 1600 mg/L, respectivamente. El porcentaje de crecimiento del hongo se redujo en el tratamiento con 800 mg/L a 77.25% y 59.61% a 1600 mg/L (F=148.71; p= 0.000).
El fenantreno generó una reducción de crecimiento del hongo a partir de 25 mg/L, con una disminución de 78.43%, 70.20%, 72.55%, 66.67%, 66.27% y 61.96% a 25, 50, 100-200, 400, 800 y 1600 mg/L, respectivamente (F = 70.50; p = 0.000). De la misma manera, el índice de tolerancia se redujo al aumentar la concentración de fenantreno hasta 0.62 a 1600 mg/L.
El pireno fue el HPA menos tóxico para T. coccinea, ya que no presentó inhibición del crecimiento hasta los 800 mg/L de pireno. Solo se apreció una ligera reducción a altas concentraciones (1600 mg/L), donde hubo una disminución significativa del crecimiento de 20.78% (F = 70.50; p = 0.000), concomitante con una reducción del índice de tolerancia (0.78).
Una vez que se determinó el efecto tóxico de los HPAs sobre el crecimiento del hongo, se tomó la decisión de trabajar en medio líquido con una concentración mínima inhibitoria de 5 mg/L considerando el efecto tóxico del fenantreno, a fin de poder comparar los efectos de los distintos HPAs sobre las actividades enzimáticas del SEDL de T. coccinea, la concentración de proteínas totales y la fitotoxicidad.
Efecto de los HPAs sobre la concentración de proteínas totales y la actividad de las enzimas ligninolíticas: La isoenzima lacasa de 68 Kda se induce en presencia de HPAs
En cuanto a la concentración de proteínas totales en el sobrenadante, se observó un incremento en el tiempo para todos los tratamientos (Figura 5). Sin embargo, se encontró una reducción en la concentración de proteínas en el sobrenadante del hongo tratado con naftaleno desde el primer día de exposición. En el día 1, se observó una reducción significativa en la concentración de proteínas totales en el sobrenadante del tratamiento con naftaleno, de 0.093±0.001 mg/mL en el control a 0.068±0.002 mg/mL (F = 14.11; p = 0.001). En el día 5, también se apreció una disminución en el contenido protéico para los tratamientos con naftaleno y fenantreno según Anova de una vía y test a posteriori de Dunnet (F = 26.64; p = 0.000). Se evidenció una reducción en el contenido de proteína en el tratamiento con naftaleno, de 0.121±0.006 mg/mL en el control a 0.085±0.011 mg/mL (F = 7.98; p = 0.000) y en el biotratado con fenantreno se redujo a 0.101±0.01 mg/mL.

Figura 5. Concentración de proteínas totales de T. coccinea en medio líquido BSM y medio BSM suplementado con 5 mg/L de naftaleno, fenantreno y pireno, durante 5 días.
Al estudiar el efecto de los HPAs sobre la síntesis de enzimas ligninolíticas, no se evidenció actividades de las enzimas guaiacol peroxidasa, LigP ni MnP. Sin embargo, se observó una fuerte inducción de la actividad lacasa en presencia de pireno y naftaleno. En la Figura 6A se observa un incremento en el tiempo para la actividad lacasa en todos los tratamientos la cual se vió fuertemente inducida en presencia de pireno y naftaleno. En el día 1, se evidenció un aumento significativo de la actividad lacasa en el sobrenadante del tratamiento con pireno, incrementando de 5.95±4.96 U/mgP en el control hasta 96.90±51.10 U/mgP (F = 5.70; p = 0.027). Para el día 3, la actividad de la lacasa incrementó en el tratamiento con naftaleno de 18.81 a 104.91 U/mgP (F = 4.98; p = 0.039) y, para el día 5, se evidenció un fuerte estímulo de esta actividad enzimática en presencia de pireno (124.85±14.76 U/mgP) y naftaleno (167.95±16.23 U/mgP) (F = 22.45; p = 0.001).
Además, los zimogramas con ABTS (Figura 6B) muestran 3 isoenzimas de la lacasa con pesos moleculares estimados de 68, 58 y 56 KDa. De estas, la isoenzima que mostró una mayor actividad en presencia de los HPAs fue la de mayor peso molecular (68 KDa), especialmente, en presencia de naftaleno y pireno. En nuestro laboratorio se realizó esta misma prueba con un sobrenadante enriquecido con almidón y se vió un incremento en la actividad de las dos isoenzimas de menor peso molecular (datos no mostrados), de donde se desprende que la activación enzimática de las distintas isoenzimas depende del sustrato, en este caso, los HPAs estudiados.
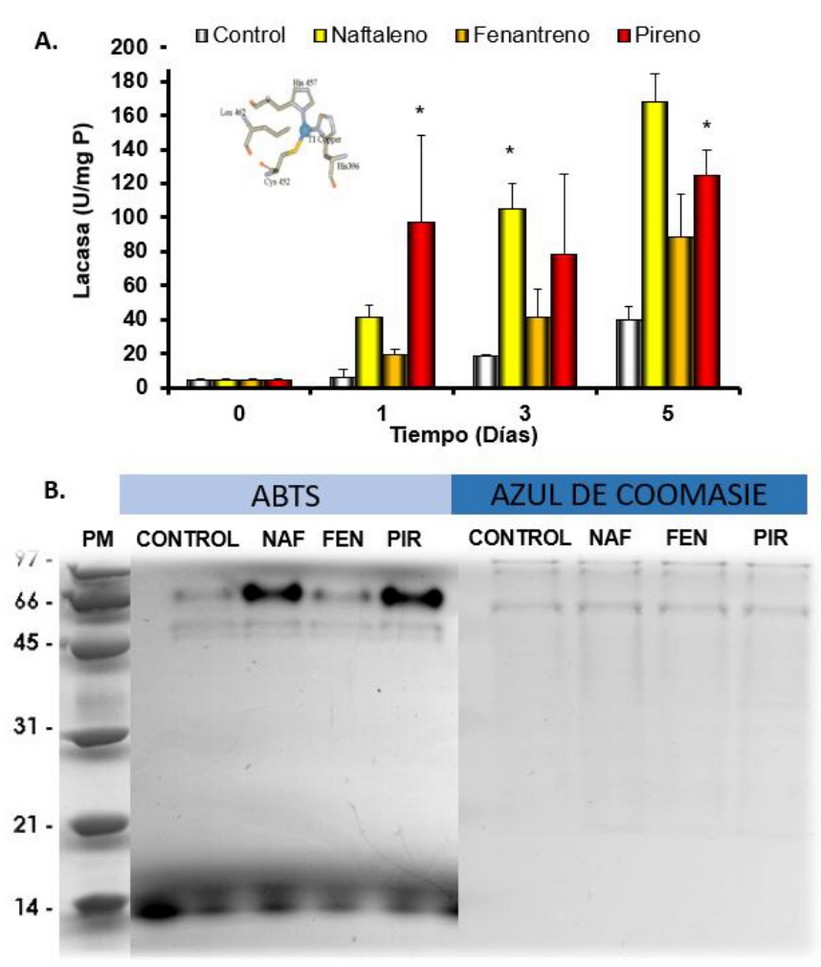
Figura 6. A. Actividad de la enzima lacasa en medio BSM control y suplementado con 5 mg/L de los diferentes HPAs B. Zimograma de los sobrenadantes de T. coccinea expuestos a los HPAs por 5 días y 5 mM de ABTS. Al lado, el mismo gel teñido con azul de coomasie. PM: peso molecular, Control: T. coccinea en medio BSM y medio BSM con 5 mg/L de NAF: naftaleno, FEN: fenantreno y PIR: pireno.
Variación en la toxicidad de los HPAs tras su biotransformación por T. coccinea: La biotransformación de pireno estimula el crecimiento de las plántulas de L. sativa.
Se observó una variación en la toxicidad de los HPAs sobre el crecimiento de L. sativa luego de ser biotratados con el hongo. Con respecto al porcentaje de germinación, se observó una disminución ante la exposición a naftaleno (91.67 %), naftaleno biotratado con T. coccinea (93.33 %), fenantreno biotratado (91.67 %), pireno (96.67 %) y pireno biotratado (95.00 %). Sin embargo, esta disminución no fue significativa con respecto al control (100 %) (p>0.05).

Figura 7. Efecto de los sobrenadantes de T. coccinea crecido en distintos HPAs sobre la germinación y el crecimiento de radículas e hipocótilos de plántulas de L. sativa expuestos a agua= control agua, BSM = control medio BSM, Tc = control hongo en medio BSM, NAF = medio BSM con 5 mg/L de naftaleno, Naf-Tc = medio BSM con naftaleno y T. coccinea, Fen = medio BSM con naftaleno, Fen-Tc= medio BSM con naftaleno y T. coccinea, Pir = medio BSM con naftaleno, Pir-Tc = medio BSM con naftaleno y T. coccinea durante 5 días. Los resultados se muestran como medias ± desviación estándar (n=30). *Estadísticamente significativas en comparación al control agua, según ANOVA de 1-vía y test de Dunnet p<0.05. B. Índice Integral de Fitotoxicidad (IIF) para las plantas de L. sativa expuestas a los distintos sobrenadantes.
Por otro lado, la longitud de las radículas de las plántulas se redujo ante la exposición a los HPAs (F = 15.54; p = 0.000). La longitud media de los controles fue de 2.01 cm, el cual disminuyó en los tratamientos de naftaleno biotratado (1.34 cm), fenantreno biotratado (1,49 cm) y pireno (1.57 cm). En el caso del pireno biotratado (2.34 cm), mostró un estímulo de crecimiento en comparación al pireno solo (1.57 cm).
Las pruebas de fitotoxicidad mostraron que ocurrió un proceso de biotransformación de los HPAs al observarse diferencias en los niveles de toxicidad de los compuestos al exponerlos al hongo. En el caso del naftaleno y el fenantreno, el contacto con el hongo generó compuestos más tóxicos que el compuesto original mientras que, por el contrario, en el caso del pireno se generaron compuestos menos tóxicos, lo que se reflejó como un estímulo significativo en el crecimiento de las plántulas de L. sativa.
En este sentido, el IIF empleado en la presente investigación, mostró que el naftaleno promueve un estímulo de crecimiento con un valor de -6 y, luego del tratamiento con T. coccinea, genera una toxicidad con un valor de IIF de 17. De igual manera que el naftaleno, el fenantreno promueve un estímulo de crecimiento de -20 y, cuando es biotratado por el hongo, se evidenció una toxicidad de 16. Por el contrario, el pireno inicialmente fue tóxico para las plantas (2) y, luego de su exposición con el hongo, se observó un estímulo del crecimiento de -20, el cual pudiera deberse a la generación de sub-productos menos tóxicos que el original, en este caso, el pireno.
DISCUSIÓN
El hongo T. coccinea aislado del Lago de Asfalto de Guanoco tiene la capacidad de tolerar ambientes extremos con altas temperaturas y contaminados con hidrocarburos recalcitrantes (83% carbono, 11% hidrógeno y 6% azufre). En el presente trabajo, la cepa aislada fue capaz de crecer sobre bajas concentraciones de HPAs sin síntomas de toxicidad. Esta capacidad podría deberse a la presión adaptativa de esta cepa al vivir en presencia de asfalto y a bajas concentraciones de nutrientes. Además de ello, una cepa de esta misma especie fue aislada por Dantán-González et al. 38, creciendo en un tronco cubierto de crudo cercano a una refinería en Veracruz, México, lo que demuestra su alta tolerancia a los hidrocarburos.
En el presente estudio no se observaron las actividades enzimáticas guaiacol peroxidasa, LigP ni MnP, resultados que coinciden con los reportados por otros autores que señalan que la principal enzima extracelular oxidativa del SEDL de P. sanguineus (formalmente T. coccinea) es la lacasa 23,24. Sin embargo, contrastan con los resultados obtenidos por Esposito et al. 20 quienes encontraron actividades LigP y MnP al exponer al hongo a extracto de malta, lo que sugiere que, aunque esta especie sintetice exoenzimas oxidativas en presencia de algunos sustratos como la malta, las mismas no se estimulan en presencia de los HPAs estudiados en la presente investigación (naftaleno, fenantreno y pireno) ni en los estudiados por Li et al. 24, quienes expusieron el hongo a fenantreno, benzo[a]antraceno y a antraceno.
Por otro lado, una posible explicación de la baja actividad lacasa los primeros días del experimento se debe a la presencia de glucosa en el medio, la cual, al irse consumiendo por el hongo, la actividad de la enzima incrementa proporcionalmente a la desaparición de la glucosa en el caldo de cultivo. A este respecto, Siqueira et al. 21 reportaron la inhibición de la producción de la α-amilasa en presencia de glucosa, por lo que sugieren que esta fuente de carbono y energía pudiera generar represión catabólica.
Al igual que en el presente trabajo, otros trabajos reportan la presencia de varias isoenzimas de la lacasa. García et al. 39 encontraron 3 isoenzimas con distintos pesos moleculares, entre ellas una de 68 KDa, lo cual coincide con la isoenzima que se activó en T. coccinea en presencia de naftaleno y pireno en nuestro estudio. De igual manera, Litthauer et al. 40 encontraron una lacasa termoestable de 58 KDa, pH óptimo 3-5, que toleraba temperaturas de 50-75°C. Así mismo, Dantán-González et al. 38 aislaron dos isoenzimas de lacasa de 68 KDa con PI de 7.00 y 7.08, respectivamente. En nuestro caso, observamos la presencia de 3 isoenzimas de pesos moleculares distintos: 56, 58 y 68 KDa. Se pudiera sugerir, que la activación de las distintas isoenzimas lógicamente podría depender del sustrato utilizado, en este caso, por los HPAs ensayados.
En este sentido, la inducción de la actividad de la lacasa de 68 KDa de T. coccinea en presencia de naftaleno y pireno, sugiere que esta enzima podría reconocer estos compuestos como sustratos con una mayor especificidad. En otras pruebas realizadas en nuestro laboratorio, observamos que la actividad de la lacasa de T. coccinea en un medio rico en almidón se vio duplicada al añadir 5 mg/L de pireno, lo que confirma la inducción de esta enzima ante la exposición a este HPA.
La capacidad de la lacasa para degradar distintos compuestos orgánicos se debe a su baja especificidad de sustrato. Se ha demostrado que ciertos compuestos recalcitrantes tales como pesticidas, colorantes, bifenilos policlorados y diversos HPAs presentan una similitud estructural con la lignina - sustrato original de la lacasa - y son degradados por la misma.
Con respecto a la toxicidad de los HPAs tratados con T. coccinea, se evidenció un incremento en la toxicidad del fenantreno al ser biotratado con el hongo. Según Li et al. 24, esta especie transforma el fenantreno en 9,10-fenantrenodiona mediado por la enzima lacasa y se conoce que las dionas son muy tóxicas. Además, se ha demostrado que esta especie degrada el fenantreno via lacasa y también por la enzima citocromo P450, donde se genera el metabolito secundario 2-methyl- phenol 24.
Aunque T. coccinea es capaz de degradar hidrocarburos y es promisorio para fines de biorremediación, se sugiere el uso de la enzima lacasa purificada (Ej. isoenzima lacasa de 68 Kda) debido a la posibilidad de generar compuestos más tóxicos al original, como en el caso de naftaleno y fenantreno. Por otro lado, se ha descrito que T. coccinea (previamente P. sanguineus) tiene propiedades antibióticas sobre varias especies bacterianas 41, lo cual podría ser contraproducente ya que, por un lado, no se pueden generar consorcios con bacterias con fines de biorremediación y, por otro lado, el hongo podría eliminar bacterias autóctonas presentes en los suelos contaminados con capacidad de mineralizar HPAs.
CONCLUSIONES
El hongo Trametes coccinea fue aislado del Lago natural de Asfalto de Guanoco y demostró tolerancia hacia los hidrocarburos naftaleno, fenantreno y pireno. Además, se evidenció que estos HPAs estimulan a la enzima lacasa, especialmente la isoenzima de 68 kDa que podría estar implicada en la oxidación inicial en el proceso de degradación de hidrocarburos. También se observó una variación en la toxicidad de los hidrocarburos sobre la especie L. sativa al ser biotratados por T. coccinea, generándose una mayor toxicidad en el caso del naftaleno y el fenantreno, mientras que, en el caso del pireno, disminuyó su toxicidad. Se recomienda trabajar con la enzima lacasa purificada para fines de biorremediación de suelos y aguas contaminados con HPAs.
AGRADECIMIENTOS
El presente trabajo fue financiado por los Proyectos FONACIT No. 2005000440, Sub-Proyecto 3: MISIÓN CIENCIA No. 2007001401, y FONACIT No. G- 2011000330, bajo la coordinación de LNB. Se agradece la participación de investigadores asociados al Proyecto “Obtención de biocatalizadores hidrocarbonoclásticos para la biorremediación de suelos contaminados con crudos recalcitrantes en la Amazonía ecuatoriana” (MBA-001-2020), financiado por la Agencia de Cooperación Internacional y Desarrollo (AECID, España, 2019-2022).
REFERENCIAS BIBLIOGRÁFICAS
1. Menzie CA, Potocki BB, Joseph S. Exposure to Carcinogenic PAHs in The Environment. Environ Sci Technol. 1992 Jul 1;26(7):1278–84.
2. Nadon L, Siemiatycki J, Dewar R, Krewski D, Gérin M. Cancer risk due to occupational exposure to polycyclic aromatic hydrocarbons. Am J Ind Med [Internet]. 1995 Sep 1 [cited 2020 Jun 8];28(3):303–24. Available from: http://doi.wiley.com/10.1002/ajim.4700280302
3. Arun a, Eyini M. Comparative studies on lignin and polycyclic aromatic hydrocarbons degradation by basidiomycetes fungi. Bioresour Technol [Internet]. 2011 Sep [cited 2012 Apr 18];102(17):8063–70. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21683591
4. Gouma S, Fragoeiro S, Bastos AC, Magan N. Bacterial and Fungal Bioremediation Strategies. In: Microbial Biodegradation and Bioremediation [Internet]. Elsevier Inc.; 2014. p. 301–24. Available from: http://dx.doi.org/10.1016/B978-0-12-800021-2.00013-3
5. Naranjo-briceño L, Pernía B, Perdomo T, González M, Inojosa Y, Sisto Á De, et al. Potential Role of Extremophilic Hydrocarbonoclastic Fungi for Extra- Heavy Crude Oil Bioconversion and the Sustainable Development of the Petroleum Industry. In: S. M. Tiquia-Arashiro MG (eds. ., editor. Fungi in Extreme Environments: Ecological Role and Biotechnological Significance [Internet]. Springer Nature Switzerland; 2019. p. 559–86. Available from: http://link.springer.com/10.1007/978-3-030-19030-9
6. Baillie GS, Hitchcock CA, Burnet FR. Increased cytochrome P-450 activity in Aspergillus fumigatus after xenobiotic exposure. Med Mycol [Internet]. 1996 Jan 1 [cited 2020 Jun 8];34(5):341–7. Available from: https://academic.oup.com/mmy/article-lookup/doi/10.1080/02681219680000581
7. Vazquez-duhalt R, Westlake DWS, Fedorak PM. Lignin Peroxidase Oxidation of Aromatic Compounds in Systems Containing Organic Solvents. 1994;60(2):459–66.
8. Baborová P, Möder M, Baldrian P, Cajthamlová K, Cajthaml T. Purification of a new manganese peroxidase of the white-rot fungus Irpex lacteus, and degradation of polycyclic aromatic hydrocarbons by the enzyme. Res Microbiol. 2006;157:248–53.
9. Wang Y, Vazquez-duhalt R, Pickard MA. Manganese – lignin peroxidase hybrid from Bjerkandera adusta oxidizes polycyclic aromatic hydrocarbons more actively in the absence of manganese. Life Sci. 2003;682:675–82.
10. Allenmark SG, Andersson MA. Chloroperoxidase-Catalyzed Asymmetric Synthesis of a Series of Aromatic Cyclic Sulfoxides. Science (80- ). 1996;7(4):1089–94.
11. Majcherczyk A, Johannes C, Hu A. Oxidation of polycyclic aromatic hydrocarbons ( PAH ) by laccase of Trametes versicolor. Enzyme. 1998;0229(97):335–41.
12. Dutta D, Ghosh DK, Mishra AK, Samanta TB. Induction of benzo(a)pyrene hydroxylase in Aspergillus ochraceus TS: Evidences of multiple forms of cytochrome P-450. Biochem Biophys Res Commun. 1983 Sep 15;115(2):692–9.
13. Gochev VK, Krastanov AI. Isolation of Laccase Producing Trichoderma Spp. Vol. 13, Bulgarian Journal of Agricultural Science. 2007.
14. Majeau JA, Brar SK, Tyagi RD. Laccases for removal of recalcitrant and emerging pollutants. Bioresour Technol [Internet]. 2010;101(7):2331–50. Available from: http://dx.doi.org/10.1016/j.biortech.2009.10.087
15. Mayer AM, Staples RC. Laccase: New functions for an old enzyme. Phytochemistry. 2002;60(6):551–65.
16. Pickard MA, Roman R, Tinoco R, Vazquez-Duhalt R. Polycyclic aromatic hydrocarbon metabolism by white rot fungi and oxidation by Coriolopsis gallica UAMH 8260 laccase. Appl Environ Microbiol. 1999;65(9):3805–9.
17. Pernía B, Rojas-Tortolero D, Sena L, De Sisto A, Inojosa Y, Naranjo L. Phytotoxicity of pah, extra-heavy crude oil and its fractions in Lactuca sativa: An integrated interpretation using a modified toxicity index. Rev Int Contam Ambient. 2018;34(1):79-91.
18. Naranjo L, Urbina H, Sisto ADE, Leon V. Isolation of Autochthonous Non-White Rot Fungi with Potential for Enzymatic Upgrading of Venezuelan Extra-Heavy Crude Oil Isolation of autochthonous non-white rot fungi with potential for enzymatic upgrading of Venezuelan extra-heavy crude oil. 2007;25(2-4):341-349.
19. González V, Vásquez P. La vegetación del Lago de Asfalto de Guanoco después de cuatro décadas. Un primer enfoque fisionómico y florístico | González. Acta Biologica Venezuelica. 2004; 24(2) [Internet]. [cited 2020 Jun 8]. Available from: http://saber.ucv.ve/ojs/index.php/revista_abv/article/view/4036/3860
20. Esposito E, Innocentini-Mei LH, Ferraz A, Canhos VP, Durán N. Phenoloxidases and hydrolases from Pycnoporus sanguineus (UEC-2050 strain): applications. J Biotechnol. 1993 Jun 1;29(3):219–28.
21. De Almeida Siqueira EM, Mizuta K, Giglio JR. Pycnoporus sanguineus: A novel source of α-amylase. Mycol Res. 1997 Feb 1;101(2):188–90.
22. Abrahão MC, Gugliotta ADM, Silva D, Fujieda Y. Ligninolytic activity from newly isolated basidiomycete strains and effect of these enzymes on the azo dye orange II decolourisation. Microbiol. 2008;58(3):32212393.
23. Zhang S, Ning Y, Zhang X, Zhao Y, Yang X, Wu K. Contrasting characteristics of anthracene and pyrene degradation by wood rot fungus Pycnoporus sanguineus H1. Int Biodeterior Biodegradation [Internet]. 2015;105:228–32. Available from: http://dx.doi.org/10.1016/j.ibiod.2015.09.012
24. Li X, Pan Y, Hu S, Cheng Y, Wang Y, Wu K, et al. Diversity of phenanthrene and benz [ a ] anthracene metabolic pathways in white rot fungus Pycnoporus sanguineus 14. Int Biodeterior Biodegrad [Internet]. 2018;134(May):25–30. Available from: https://doi.org/10.1016/j.ibiod.2018.07.012
25. Casqueiro J, Bañuelos O, Gutiérrez S, Hijarrubia MJ, Martín JF. Intrachromosomal recombination between direct repeats in Penicillium chrysogenum: Gene conversion and deletion events. Mol Gen Genet. 1999;261(6):994–1000.
26. Montenegro E, Fierro F, Fernandez FJ, Gutierrez S, Martin JF. Resolution of chromosomes III and VI of Aspergillus nidulans by pulsed- field gel electrophoresis shows that the penicillin biosynthetic pathway genes pcbAB, pcbC, and penDE are clustered on chromosome VI (3.0 megabases). Vol. 174, Journal of Bacteriology. J Bacteriol; 1992. p. 7063–7.
27. Naranjo L, De Valmaseda EM, Bañuelos O, Lopez P, Riaño J, Casqueiro J, et al. Conversion of pipecolic acid into lysine in Penicillium chrysogenum requires pipecolate oxidase and saccharopine reductase: Characterization of the lys7 gene encoding saccharopine reductase. J Bacteriol. 2001;183(24):7165–72.
28. Evans GA. Molecular cloning: A laboratory manual. Second edition. Volumes 1, 2, and 3. Current protocols in molecular biology. Volumes 1 and 2. Cell. 1990 Apr 6;61(1):17–8.
29. Altschul S, Madden T, Schäffer A, Zhang J, Zhang Z, Miller W, et al. A simple sequence repeat-based linkage map of Barley. Nucleic Acids Res. 1997;25(17):3389–402.
30. Pearson WR, Lipman DJ. Improved tools for biological sequence comparison. Proc Natl Acad Sci U S A. 1988;85(8):2444–8.
31. Kerem Z, Friesem D, Hadar Y. Lignocellulose degradation during solid-state fermentation: Pleurotus ostreatus versus Phanerochaete chrysosporium. Appl Environ Microbiol. 1992;58(4):1121–7.
32. Chaoui A, Ghorbal MH, El Ferjani E. Effect of cadmoium-zinc interactions on hydroponically grown bean (Phaseolus vulgaris L.). Plant Sci. 1997;126:21–8.
33. Troller J, Smit JDG, Leisola MSA, Kallent J, Winterhalter KH, Fiechter A. Crystallization of a lignin peroxidase from the white-rot fungus Phanerochaete chrysosporium. Bio/Technology. 1988;6(5):571–3.
34. Papinutti L, Forchiassin F. Optimization of manganese peroxidase and laccase production ´ v .) Cke in the South American fungus Fomes sclerodermeus ( Le. FEMS Microbiol Lett. 2003;536–41.
35. Carlos M, Saparrat N, Martínez MJ, Cabello MN, Arambarri AM. Screening for ligninolytic enzymes in autochthonous fungal strains from Argentina isolated from different substrata. Culture. 2002;181–5.
36. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976 May 7;72(1–2):248–54.
37. Distefano S, Palma JM, Gómez M, Del Río LA. Characterization of endoproteases from plant peroxisomes. Biochem J. 1997 Oct 15;327(2):399–405.
38. Li H-J, He S-H. Three species of polypores new to China. Mycosistema. 2014 Sep 15;33(5):967–75.
39. Dantán-González E, Vite-Vallejo O, Martínez-Anaya C, Méndez- Sánchez M, González M, Palomares L, et al. Caracterización de la lacasa de una cepa termotolerante de Pycnoporus sanguineus. Int Microbiol. 2008;11(3):163-169.
40. Garcia TA, Santiago MF, Ulhoa CJ. Studies on the Pycnoporus sanguineus CCT-4518 laccase purified by hydrophobic interaction chromatography. Appl Microbiol Biotechnol. 2007 May 11;75(2):311–8.
41. Litthauer D, van Vuuren MJ, van Tonder A, Wolfaardt FW. Purification and kinetics of a thermostable laccase from Pycnoporus sanguineus (SCC 108). Enzyme Microb Technol. 2007 Mar 5;40(4):563–8.
42. Smânia A, Monache FD, Smânia EFA, Gil ML, Benchetrit LC, Cruz FS. Antibacterial activity of a substance produced by the fungus Pycnoporus sanguineus (Fr.) Murr. J Ethnopharmacol. 1995;45(3):177–81.
Recibido: 25 marzo 2021
Aceptado: 6 julio 2021
Beatriz Pernía1,2*, Hector Urbina1,3, Meralys González1, Lucia Sena1, Yanet Villasana4, Leopoldo Naranjo-Briceño1,5
1Área de Energía y Ambiente, Fundación Instituto de Estudios Avanzados (IDEA), Carretera Nacional Baruta-Hoyo de la Puerta, Valle de Sartenejas, CP, Caracas, Venezuela
2Instituto de Investigaciones de Recursos Naturales, Facultad de Ciencias Naturales, Universidad de Guayaquil, CP, Guayaquil, Ecuador. ORCID ID: 0000-0002-2476-7279
3Division of Plant Industry, Florida Department of Agriculture,
Gainesville, FL, USA. ORCID ID: 0000-0002-5570-4537
4Grupo Biomass to Bioresources, Universidad Regional Amazónica Ikiam, CP, Tena, Ecuador. ORCID ID: 0000-0002-6677-5541
5Grupo de Microbiología Aplicada, Universidad Regional Amazónica Ikiam, CP, Tena, Ecuador. ORCID ID: 0000-0003-4838-0818
*Corresponding author: Ph.D. Beatriz Pernía, [email protected]
