2017.02.04.11
Files > Volume 2 > Vol 2 No 4 2017
REVISION/REVIEW
Valorización del suero de leche: Una visión desde la biotecnología
Milk whey valorization: An overview from Biotechnology
José M. Pais Chanfrau1*, Jimmy Núñez Pérez1, Marco V. Lara Fiallos1, Leonor M. Rivera Intriago2,3,
Luis E. Trujillo Toledo4, Milton J. Cuaran Guerrero1.
Luis E. Trujillo Toledo4, Milton J. Cuaran Guerrero1.
http://dx.doi.org/10.21931/RB/2017.02.04.11
_______________________________________________________________________________________________________________________
RESUMEN
La Zona 1 del Ecuador (provincias de Esmeraldas, Carchi, Ibarra y Sucumbíos) es una región eminentemente ganadera, donde se alcanzan importantes volúmenes de leche, en especial, en las provincias andinas del Carchi e Ibarra. Casi un tercio de toda la leche se destinan a la producción de los diferentes tipos de quesos, generándose cantidades apreciables de suero de leche. Una parte importante del suero de leche se emplea en la alimentación animal, más otra, es vertida a los ríos, arroyos y quebradas, contaminando las fuentes naturales de agua. Regulaciones medioambientales más rigurosas, por un lado, y la toma de conciencia por otra, han puesto en evidencia la necesidad de transformar el suero de leche en efluentes menos contaminantes. Si adicionalmente se logra que como resultado de esta transformación se lograran obtener nuevos productos de mayor valor agregado que el propio suero de leche, se amortizaría en parte los recursos empleados en la transformación. En la presente revisión se exploran, desde las biotecnologías, algunas de las tecnologías disponibles y se discuten las vías para lograrlo en el contexto de la Zona 1 del Ecuador.
Palabras claves: suero de leche, permeado de suero de leche, proteína unicelular, ácido láctico, kefirán, galacto-oligosacáridos.
____________________________________________________________________________________________________________________
ABSTRACT
Zone 1 of Ecuador (provinces of Esmeraldas, Carchi, Ibarra and Sucumbíos) is an eminently cattle region, where important daily volumes of milk are reached, especially the Andean provinces of Carchi and Ibarra. Almost a third of all milk is used for the production of different types of cheeses, generating considerable amounts of whey. An important part of whey is used in animal feed, plus another, is poured into rivers, streams and badlands, polluting natural sources of water. More stringent environmental regulations on the one hand and awareness on the other have highlighted the need to transform whey into less polluting effluents. If, as a result of this transformation, it is possible to obtain new products with higher added value than the whey itself, the resources used in the transformation would be partially amortized. In the present review, some of the available technologies are explored from biotechnologies, and ways to achieve this are explored in the context of Zone 1 of Ecuador.
Key words: Milk whey, whey permeate, single-cell protein, lactic acid, kefiran, galacto-oligosaccharides.
_______________________________________________________________________________________________________________________
INTRODUCCIÓN
En la Zona 1 del Ecuador (Carchi, Imbabura, Esmeraldas y Sucumbíos) la actividad agrícola y ganadera ocupa una parte importante de la actividad económica y laboral de estos territorios. La mayor parte de la población de esta Zona se dedica a la producción y comercialización de leche, siendo la provincia del Carchi la que más se destaca alcanzando un 4,8% de la producción nacional de leche, alcanzando una producción diaria de alrededor de 79.8 m3 1. De acuerdo con el Ministerio de Coordinación de la Producción, Empleo y Competitividad en el 2011, la provincia del Carchi la actividad principal es el procesamiento lácteo, que genera un valor de producción de alrededor de US$ 3.5 millones, lo que implica una generación de valor agregado de US$ 702 mil. Esta actividad representa el 61% de la producción industrial a nivel provincial. La producción artesanal de transformación no está considerada dentro de estos datos, la cual es bastante importante en términos de producción de derivados lácteos. Uno de los derivados más consumidos después de la leche fluida es el queso y en el Ecuador los quesos frescos son los más apetecidos: criollo, mozzarella, amasado y cuajadas en general2. En los últimos ocho años el consumo per cápita de queso se duplicó, este pasó de 0.75 kg por persona al año en el 2006 a 1.57 kg el año 20142. Las ventas de la industria quesera crecieron 3.4 veces entre el 2006 y el 2014, al pasar de US$ 71.4 millones a 243.1 millones en éste período. Alrededor de un tercio de la producción lechera de la región se dedica a la producción de los diferentes tipos de queso2. Como resultado de la producción de los diferentes tipos de quesos, se obtiene el suero de leche (SL). Por cada 100 kg de leche empleados para producir quesos, se obtienen 9.3 ± 0.7 kg de queso fresco3 y alrededor 90.7 kg de suero de leche4,5. El SL retiene gran parte de los nutrientes de la leche, de ahí que este subproducto posea un elevado poder contaminante alcanzando valores de DBO5, de entre 30-50 kg m-3 6.Se han propuesto diversas soluciones a este problema desde la biotecnología4,6,7, los cuales abarcan desde el empleo del suero en la alimentación animal8 hasta su tratamiento biológico con lodos para producir abonos orgánicos para el mejoramiento de los suelos9.Uno de los usos más atractivos es en la obtención de productos basados en el aislamiento de las proteínas del suero10, brindando un concentrado proteico de excelente calidad para el consumo humano y animal11. Sin embargo, como resultado del proceso de aislamiento de las proteínas del suero se obtiene un permeado de suero (PS) de leche con niveles muy altos de lactosa, y por ende con elevados valores de carga contaminante12–14. Diversos usos han sido propuestos para el PS, que abarcan desde la producción de proteína unicelular microbiana para la alimentación animal15,16, la producción de ácidos orgánicos17,18, etanol19, hasta la obtención de pro-bióticos20 y diferentes sustancias prebióticas21–23. Estas soluciones no solo podrían lograr disminuir la carga contaminante del PS de leche, sino que permiten valorizar este subproducto al obtener diversas sustancias de mayor valor agregado. El objetivo de esta revisión es explorar diversas soluciones técnicas que contribuyan al empleo y valorización del suero de leche o su permeado desde las biotecnologías, y que contribuyan a incentivar el continuo crecimiento de la Industria láctea de la Zona 1 del Ecuador.
El suero de leche – subproducto de la producción de quesos, la principal limitante para el crecimiento del sector lechero.
Según el Instituto Nacional de Estadísticas y Censos del Ecuador, en el 2012 se registraron un promedio de 5,6 millones de litros de leche diarios a nivel nacional. En la región Sierra la producción de leche llega al 76,7% del total, Imbabura y Carchi producen del 7.4% de la producción nacional de leche, esto es más de 407 m3 diarios. Alrededor de un tercio de toda la leche se emplea en la producción de los diferentes tipos de quesos2, lo que representa alrededor de 135.67 m3 diarios de leche. Estos volúmenes generan alrededor de 122 m3 diarios de suero de leche en las provincias de Imbabura y el Carchi. El suero de leche (SL), representa el 85-95% del volumen de leche y retiene el 55% de todos los nutrientes contenidos en la leche5,24, por lo que constituye el principal subproducto y el mayor contaminante en la producción quesera6,25,26, alcanzando valores de DQO y DBO5 de entre 60-80 y de 30-50 kg m-3, respectivamente27,28. A nivel mundial se producía en el año 2013, alrededor de 180 millones de toneladas métricas (TM) de suero de leche29, de los cuales, se utilizan algo más del 40% en la alimentación animal directa, como fertilizante o se desecha, mientras que el resto se transforma en la industria, básicamente en la producción de suero en polvo, lactosa y concentrados de proteínas del suero. Como hace notar acertadamente Kosikowski5 no es lo mismo “desechar” que “utilizar” el suero de leche. Aún hoy, importantes cantidades de SL son vertidos en ríos y quebradas, o son asperjados directamente en los campos cultivados, previa dilución5. Esto último, a pesar de las ventajas aparentes que pudieran ser observadas, luego de largos periodos de vertimiento, el elevado contenido de sal en el SL tiende a salinizar los suelos, disminuyendo así los rendimientos agrícolas. Adicionalmente, cada vez más se tiene mayor conciencia en estos efectos adversos y las normas y leyes ambientales de los estados tienden a prohibir estas prácticas. Como consecuencia de ello, a pequeños y medianos productores de quesos, pudiera hacérseles difícil competir en el mercado con las grandes empresas, ante la necesidad de disponer de adecuadas plantas de tratamiento de residuales donde tratar sus efluentes de suero de leche. Esta “presión” medioambiental y regulatoria se convertiría en una limitante al crecimiento de la producción de los pequeños y medianos productores de quesos. Existen numerosas revisiones sobre los diferentes usos a los que puede destinarse el SL30–32. En primera instancia, el SL puede emplearse en la propia alimentación animal, debido a las importantes cantidades de lactosa (4.5-5% (m/v)), proteínas (0.6-0.8% (m/v)), lípidos (0.4-0.5% (m/v)) y sales minerales (8-10% en base seca) que contiene el suero de leche28. En la Figura 1, se muestran varios de los usos a que puede destinarse el suero de leche.
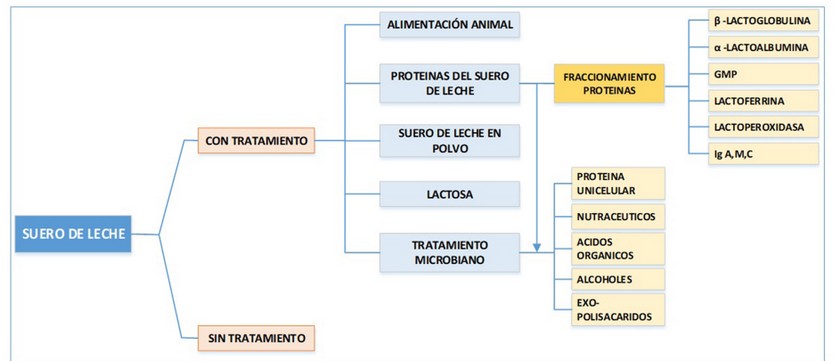
Figura 1. Algunos usos reportados del suero de leche.
Entre los usos más promisorios está el basado en el aislamiento de las proteínas del suero de leche33,34, por la elevada calidad de estas proteínas y sus efectos benéficos sobre la salud humana y animal11,35,36 y la simplicidad del proceso (Fig. 2). La tecnología de membranas es la más empleada en la concentración del SL37,38. El proceso se basa en sucesivos pasos de ultrafiltración (UF) y ósmosis inversa (RO), seguidos de la evaporación y el secado por aspersión (spray-drier).
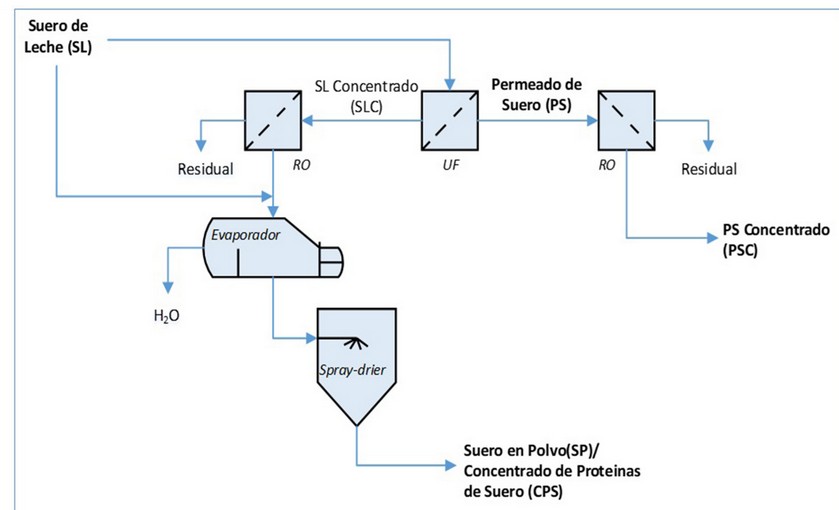
Figura 2. Proceso de obtención de concentrado de proteínas de suero (CPS).
Sin embargo, como resultado de esta tecnología se obtiene un permeado del suero (PS) de leche, des-proteinizado, subproducto rico en lactosa (3.9-4.8% (m/v)), sales minerales y cenizas (0.3-0.8% (m/v)) y trazas de proteínas (0.1-0.3% (m/v))39, lo que le confiere niveles de DBO5 > 30 kg m-3 40 y, por ende, un elevado poder contaminante, por lo que ha de ser tratado o utilizado como materia prima para otros procesos. La principal causa de su elevado valor de DBO5 es la lactosa, un disacárido que tiene usos en las industrias química, alimentaria y farmacéutica41–43.
Procesos biotecnológicos basados en la acción microbiana sobre el permeado de suero (PS).
Otro grupo de productos pueden ser obtenidos por la biotransformación de la lactosa presente en el PS. Algunas revisiones del tema han sido realizadas7,29,31,33 las cuales muestran las variadas posibilidades que existen para valorizar este subproducto. Uno de los productos que pueden ser obtenidos es el ácido láctico (C3H6O3, CAS L(+): 79-33-4). Este ácido orgánico tiene usos en la industria alimenticia y cosmética44–46. El L(+)-ácido láctico puede ser obtenido a partir de la biotransformación de la lactosa por cepas de Lactobacillus spp., como el Lactobacillus casei34,47–49. Este proceso puede ser realizado por la transformación microbiana directa50–52, o inmovilizando las células microbianas y empleando un cultivo continuo en un biorreactor empacado de células inmovilizadas53,54, como se muestra en la Figura 3. El proceso convencional consiste, brevemente, en una etapa de fermentación donde se suplementa el PS con sales y vitaminas, para lograr el crecimiento de la BAL seleccionada (por ejemplo, Lactobacillus casei), manteniendo el pH cerca de las condiciones óptimas de crecimiento47,52. Posteriormente, se separan y lavan, la biomasa obtenida y el lactato de calcio por centrifugación diferencial. El lactato de calcio, luego es convertido en ácido láctico por la adición de ácido sulfúrico. Seguidamente, el ácido láctico es separado del poco soluble sulfato de calcio. Finalmente, el ácido láctico es concentrado por evaporación hasta alrededor del 50% (v/v) (Fig. 3A). En otra alternativa, pudiera inmovilizarse células de BAL, en alginato de calcio, y conformar un biorreactor continuo enzimático, para convertir el lactato presente en el PS, en ácido láctico53–55 (Fig. 3B). Adicionalmente, de este proceso pudiera obtenerse la biomasa liofilizada del L. casei, un reconocido probiótico56 cuya ingesta confiere beneficios a la salud humana56–58. La lactosa presente en el SL, PS o el PSC pudiera ser usada para obtener proteína unicelular (PUC) microbiana, empleando, por ejemplo, la levadura Kluyveromyces marxianus15,59, una levadura reconocida como segura (estatus GRAS) y capaz de metabolizar la lactosa y alcanzar altas densidades celulares. Adicionalmente, esta levadura, es capaz de producir niveles importantes de etanol60–62, de amplios usos en toda la industria. Un posible esquema productivo para la producción de PUC y etanol a partir del SL, PS o PSC y K. marxianus se muestra en la Figura 4. Brevemente, el proceso consiste en una etapa formada por la fermentación (continua o semicontinua) donde crecerá la levadura escogida (por ejemplo, K. marxianus). Posteriormente, previa inactivación térmica del cultivo, se separan y lava la biomasa del sobrenadante. Finalmente, se seca por aspersión la biomasa, mientras que del sobrenadante puede ser recuperado por destilación el alcohol etílico (grado técnico) obtenido60,63.
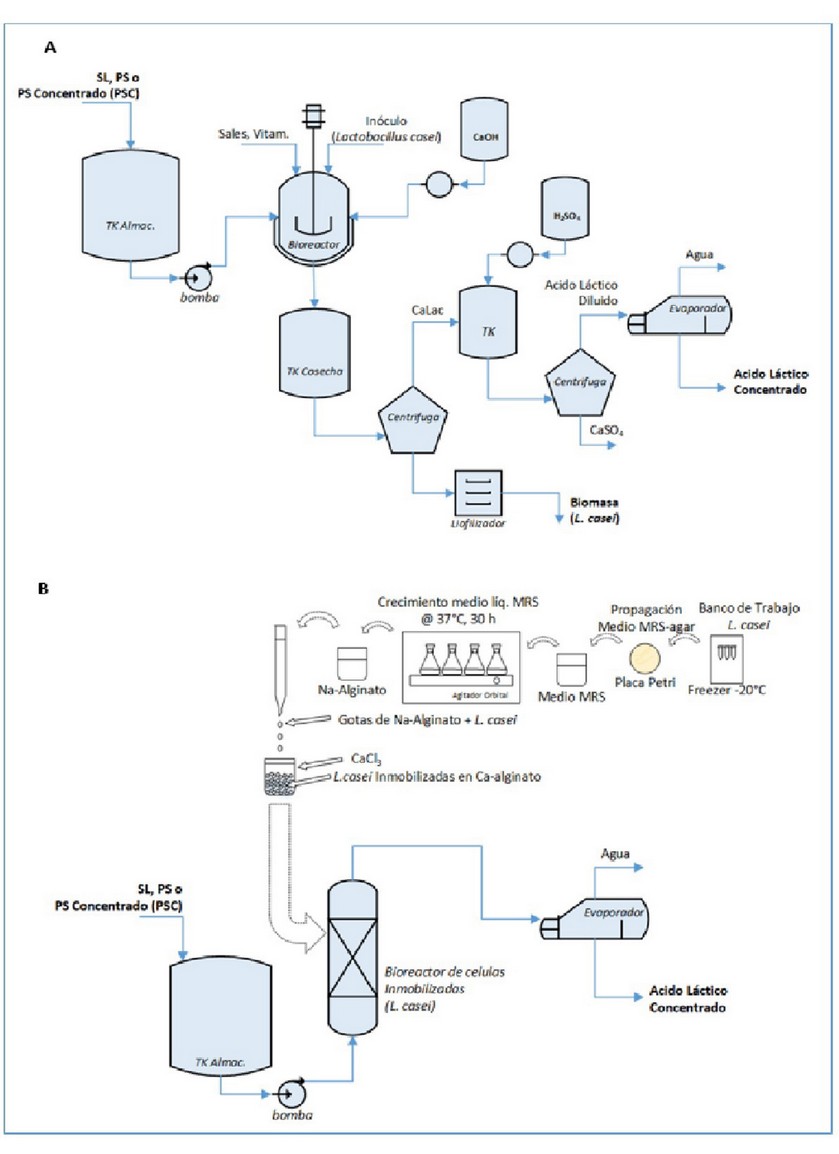
Figura 3. Producción de ácido láctico a partir del SL por (A) transformación microbiana con L. casei; (B) transformación enzimática mediante células de L. casei inmovilizadas.
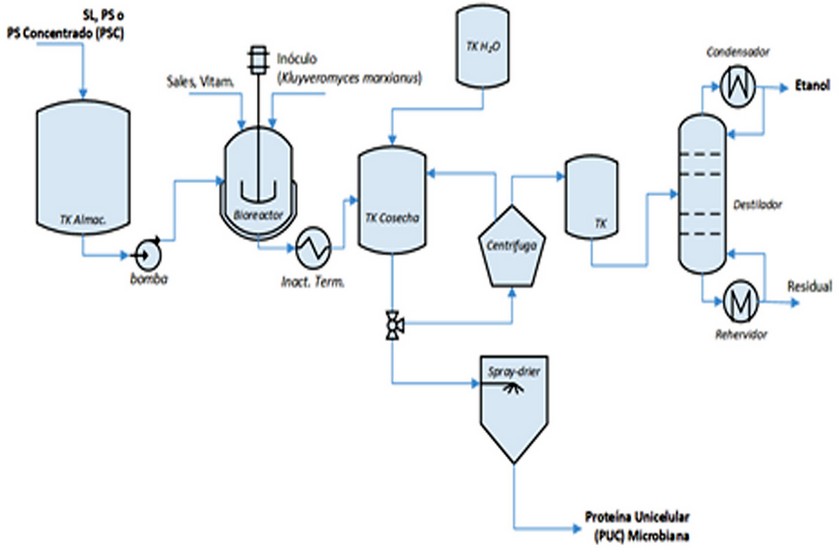
Figura 4. Diagrama de Flujo de producción de PUC y etanol, a partir de SL y la levadura K. marxianus.
Otros ácidos orgánicos, como el ácido propiónico18,64,65, ácido butírico66 y ácido cítrico67 también han sido producidos por vía microbiana a partir del suero de leche. De igual manera, otros alcoholes, como el butanol han sido biosintetizados a partir de determinadas cepas microbianas y el suero de leche68,69.Finalmente, un consorcio formado por bacterias ácido lácticas (BAL) y levaduras, que cohabitan dentro de un polímero denominado kefirán, y que se denomina gránulo de kéfir, ha sido empleado desde tiempos ancestrales para producir una leche fermentada denominada kéfir de elevados valores nutricionales70,71. Los gránulos de kéfir pudieran emplearse para bio-transformar al SL, PS o el PSC, rico en lactosa, para producir kefirán, un biopolímero comestible, formado por unidades de glucosa y galactosa en proporciones aproximadamente iguales72,73. Recientes estudios74–76, han demostrados varias propiedades beneficiosas para la salud en este biopolímero que lo hacen atractivo en la formulación de fármacos76–79 y en la conservación de alimentos80. Debido a ello, ha crecido recientemente el interés en producir este biopolímero comestible y biodegradable81. Un posible diagrama de proceso para la producción del kefirán a partir del SL, PS o el PSC y gránulos de kéfir, se muestra en la Figura 5. El proceso consiste, en la biotransformación de la lactosa presente en el PS o PSC, por las BAL del consorcio existente en el gránulo de kéfir. Al cabo de unas 48 h y finalizada la etapa de fermentación, se homogeniza el cultivo y se pasteuriza, para inactivar las enzimas hidrolíticas, posteriormente se separan los restos celulares y se precipita el kefiran soluble con etanol, después de determinado tiempo, se centrifuga y separa el precipitado, el cual es sometido a varios lavados con agua caliente, hasta eliminar los restos de lactosa. Finalmente, el kefiran puede ser secado al horno a 60°C por 24 h81.
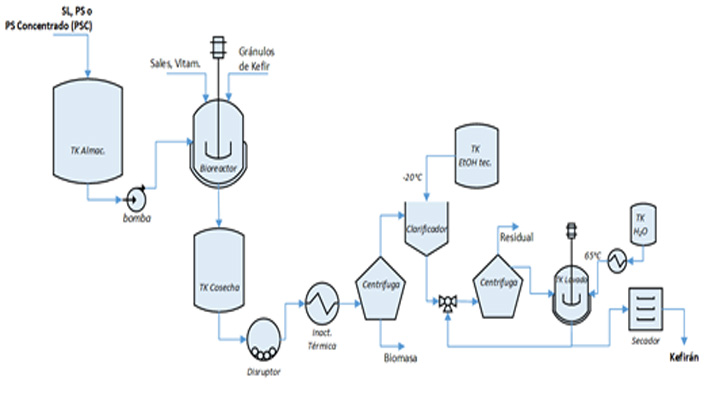
Figura 5. Diagrama de Flujo del Proceso de producción de kefirán a partir del SL, PS o PSC y gránulos de kéfir.
Procesos biotecnológicos basados en la acción enzimática sobre el permeado de suero (PS).
Por último, algunas enzimas, como la enzima hidrolítica beta-galactosidasa (EC 3.2.1.23), pudieran ser empleadas para hidrolizar o polimerizar la lactosa, presente en el SL, PS o el PSC. A concentraciones menores al 30% (m/v) predomina la hidrólisis de la lactosa en glucosa y galactosa82; mientras que, a concentraciones mayores pudiera favorecerse la reacción de la trans-galactosilación y la formación de galacto-oligosacáridos (GOS)83. Algunos autores han destacado los efectos benéficos de los GOS sobre la salud humana84,85, considerándolos sustancias prebióticas86,87. En la hidrólisis de la lactosa, ésta se favorece a concentraciones por debajo de 30% (m/v) de lactosa21,82,83,88,89. En este caso se favorece la reacción enzimática de hidrolisis:
Donde Lac, Glu y Gal representan a la lactosa (Glu-Gal), la glucosa y la galactosa, respectivamente. Puede ser acoplado al tanque colector un sistema de nano-filtración que permita separa la lactosa de la glucosa y la galactosa. La lactosa puede ser reutilizada, mientras que la mezcla de glucosa y la galactosa, puede ser concentrada hasta niveles comercializables, por evaporación. En el caso de que la concentración de lactosa sea > 30-35% (m/v), se favorecería la trans-galactosilación de la lactosa, y pudiera obtenerse galacto-oligosacáridos de diferentes grados de polimerización (n>2), dependiendo del número de especies diferentes de GOS y de las condiciones de la reacción enzimática.
Apuntes para los análisis de factibilidad económica.
La valorización del suero de leche es una decisión estratégica para las Empresas Lácteas debido a que con ello se logra “destrabar” las limitaciones que el SL le impone al crecimiento continuo de la producción lechera. Sin embargo, siempre es deseable que la inversión necesaria para la implementación de algunas de las tecnologías arriba descritas pueda ser amortizada y brinde ganancias en plazos razonables. Para el análisis económico completo, deben ser tenidas en cuenta cada tecnología en particular, las predicciones de crecimiento del sector, la demanda del mercado y la disponibilidad financiera de las Empresas90,91.A partir de 100 kg de leche fresca, y un rendimiento promedio de 9.30 ± 0.7 kg en la producción de las diferentes clases de queso3 y la generación de alrededor de 90.70 kg de suero de leche dulce, se comparan algunos de los rendimientos reportados y precios de referencia para un grupo de tecnologías (Tabla 1).
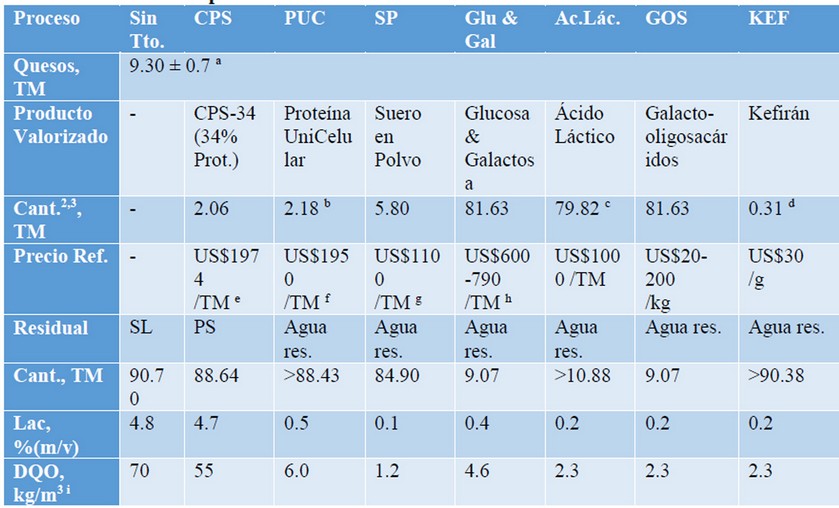
Tabla 1. Datos comparativos. Base de Cálculo: 100 TM de leche fresca.
a Valor promedio reportado3
b Asumiendo un rendimiento Yxs=0.52 TM Biom. Seca TM lactosa-1 92, de manera que: 0.52*(90.70/1.04)*(48/1000)=2.18 TM y una reducción del 80-90% de la DQO.
c Asumiendo un proceso de 36 h donde se consumió el 95.6% de la lactosa presente en el suero (4%) y se alcanzó una concentración de ácido láctico de 33.73 g L-1 52. Por tanto: YPX=33.73/(0.956*40)=0.88 TM ácido láctico TM lactosa-1 y dens. @ 80% = 1.2 TM m-3; Vol. sirope @ (80% (m/v)) = 0.88*90.70/0.8 = 99.77 m3 sirope.
d Resultado sin publicar.
e Tomado de: http://www.clal.it/en/?section=sieroproteine (7 de julio 2017)
f Tomado de: https://wholesaler.alibaba.com/product-detail/Manufacture-wholesale-price-instant-dry-yeast_60614513305.html?spm=a2700.7782932.1998701000.11.0W8xnR (14 de julio 2017)
g Tomado de: http://www.clal.it/en/?section=whey (7 de julio 2017)
h Tomado de: https://www.alibaba.com/product-detail/Fructose-Glucose-Maltose-rice-syrup-Factory_60669804468.html?spm=a2700.7724838.2017115.231.87bIGj&s=p (17/7/2017)
i Valores asumidos en proporción con la concentración de lactosa en el permeado de suero (PS) de leche.
Como se observa, los precios de los productos varían desde aquellos que están por debajo del que se obtendría de la comercialización de la propia leche fresca (8.3 kg leche fluida kg leche entera en polvo-1, por tanto: 100 TM leche fluida equivalen a 12 TM de leche entera en polvo aproximadamente y cuyo precio ronda US$3 200/TM), hasta aquellos que sobrepasan los dos dígitos al de la leche (Fig. 6). Estos valores permiten clasificar a las tecnologías de valorización del suero de leche, en aquellas que brindan bajos, medios y altos ingresos (Fig. 6).
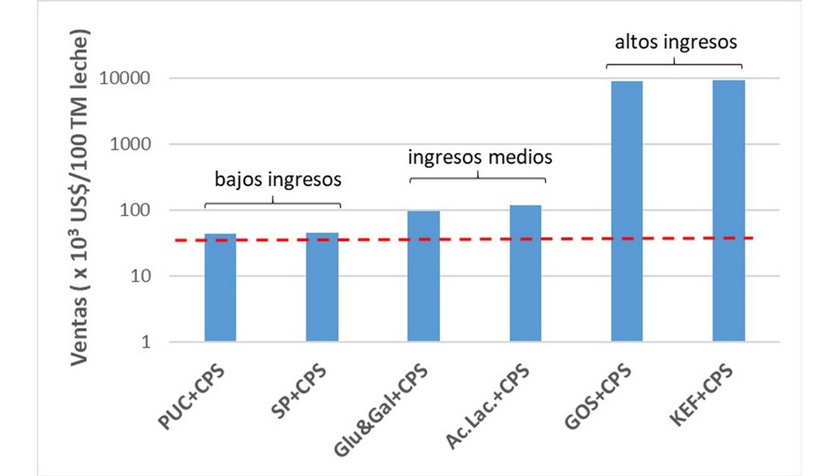
Figura 6. Comparación entre algunas de las tecnologías existentes para la valorización del suero de leche. La línea discontinua representa el precio de la leche en polvo que se obtiene de procesar 100 TM de leche fluida entera.
Adicionalmente, nótese que, durante el proceso de valorización del suero de leche, se logra disminuir apreciablemente la carga contaminante de los efluentes, que es una de las razones de la implementación de estas tecnologías. Pasando de efluentes que requieren tratamientos primarios, secundarios y terciarios (para el tratamiento del SL y PS), a efluentes menos contaminantes, que presumiblemente, solo requieran de un tratamiento primario, lo que abarataría los costos del tratamiento en las Empresas Lácteas.
CONCLUSIONES
La Zona 1 del Ecuador y específicamente las provincias de Carchi e Imbabura, son netamente ganaderas. Una porción importante de la población económicamente activa de estas provincias se dedica a la producción y comercialización de quesos, prevaleciendo los pequeños y medianos productores. Al incrementarse las regulaciones medio-ambientales y paulatinamente, la conciencia ecológica de los productores se hace cada vez más difícil verter, los excedentes lecheros e importantes cantidades de suero de leche en ríos, arroyuelos y quebradas. Por tanto, el crecimiento del sector lechero y quesero de pequeños y medianos productores se ve limitado por los elevados volúmenes de suero de leche que esto traería como consecuencia, dado a los elevados valores de DQO y DBO de este subproducto.
Una alternativa consiste en buscar disminuir el impacto de los efluentes mediante la búsqueda de tecnologías que utilicen al suero de leche como materia prima de partida, como las discutidas anteriormente en esta revisión.
Sin embargo, para poder implementar estas tecnologías es indispensable acometer un proceso inversionista y disponer de determinados recursos financieros que, difícilmente, estén al alcance de los pequeños y medianos productores de leche y queso, aun cuando éstos eventualmente puedan asociarse en cooperativas para estos fines.
Una posible solución es buscar financiamiento externo, provenientes o del sector privado o del sector estatal, o establecer convenientemente, alianzas público-privadas que permitan acceder a recursos financieros y fomentar emprendimientos, y que permitan, al disponer de estas instalaciones, estimular y fomentar incrementos futuros de la producción de leche entre los pequeños y medianos productores de la Zona 1 y de todo el Ecuador.
La Academia (Universidades, Institutos Técnicos y Centros de Investigaciones), por su parte, pudiera contribuir en aportar los estudios, los desarrollos y las tecnologías más adecuadas, así como en la formación de los emprendedores que puedan acometer estos proyectos. Todos estos esfuerzos, en su conjunto pudieran confluir para garantizar el continuo crecimiento de la producción lechera de la Zona 1 del Ecuador en los venideros años.
Adicionalmente, con las nuevas instalaciones, se generarían nuevas fuentes de trabajo, se sustituirían importaciones actuales y se estaría cambiando y ampliando, la matriz productiva del Ecuador.
REFERENCIAS
1. Requelme, N. & Bonifaz, N. Caracterización de sistemas de producción lechera de Ecuador. Univ. Politécnica Sales. Ecuador. Rev La … 15, 55–68 (2012).
2. Orozco, M. Un tercio de la producción láctea se dedica al queso. Líderes 1 (2015).
3. Dalla Costa, C. A. RENDIMIENTO QUESERO TEÓRICO Y REAL DE LA LECHE DE LA CUENCA DE VILLA MARÍA, CÓRDOBA. (Universidad Católica de Córdova, Argentina., 2015).
4. Parra, R. a. Whey?: importance in the food industry. Rev. Fac. Nac. Agropecu. Medellín 62, 4967–4982 (2009).
5. Kosikowski, F. V. Whey Utilization and Whey Products. J. Dairy Sci. 62, 1149–1160 (1979).
6. Marwaha, S. S. & Kennedy, J. F. Whey—pollution problem and potential utilization. Int. J. Food Sci. Technol. 23, 323–336 (1988).
7. Ryan, M. P. & Walsh, G. The biotechnological potential of whey. Reviews in Environmental Science and Biotechnology 15, 479–498 (2016).
8. Cieslak, D. G., Benevenga, N. J. & Grummer, R. H. The evaluation of fresh sweet liquid whey as a protein supplement to maize for growing pigs. Anim. Feed Sci. Technol. 14, 171–181 (1986).
9. Zupan?i?, G. D. et al. Characterization of food waste as feedstock for anaerobic digestion. Bioresource Technology 2, (2013).
10. Sinha, R., Radha, C., Prakash, J. & Kaul, P. Whey protein hydrolysate: Functional properties, nutritional quality and utilization in beverage formulation. Food Chem. 101, 1484–1491 (2007).
11. de Wit, J. N. Nutritional and Functional Characteristics of Whey Proteins in Food Products. J. Dairy Sci. 81, 597–608 (1998).
12. Cuartas-Uribe, B. et al. A study of the separation of lactose from whey ultrafiltration permeate using nanofiltration. Desalination 241, 244–255 (2009).
13. Cuartas-Uribe, B., Vincent-Vela, M. C., Álvarez-Blanco, S., Alcaina-Miranda, M. I. & Soriano-Costa, E. Nanofiltration of sweet whey and prediction of lactose retention as a function of permeate flux using the Kedem-Spiegler and Donnan Steric Partioning models. Sep. Purif. Technol. 56, 38–46 (2007).
14. Narong, P. & James, A. E. Efficiency of ultrafiltration in the separation of whey suspensions using a tubular zirconia membrane. Desalination 219, 348–357 (2008).
15. Somaye, F., Marzieh, M. & Lale, N. Single Cell Protein ( SCP ) production from UF cheese whey by Kluyveromyces marxianus. 18 th Natl. Congr. Food Technol. 8–13 (2005).
16. Yadav, J. S. S. et al. Food-grade single-cell protein production, characterization and ultrafiltration recovery of residual fermented whey proteins from whey. Food Bioprod. Process. 99, 156–165 (2016).
17. Li, Y. & Shahbazi, A. Lactic Acid Recovery From Cheese Whey Fermentation Broth Using Combined Ultrafiltration and Nanofiltration Membranes. Appl. Biochem. Biotechnol. 129–132, 985–996 (2006).
18. Colomban, A., Roger, L. & Boyaval, P. Production of propionic acid from whey permeate by sequential fermentation, ultrafiltration, and cell recycling. Biotechnol. Bioeng. 42, 1091–1098 (1993).
19. Jedrzejewska, M. & Kozak, K. Ethanol production from whey permeate in a continuous anaerobic bioreactor by Kluyveromyces marxianus. Environ. Technol. 32, 37–42 (2011).
20. Lavari, L., Páez, R., Cuatrin, A., Reinheimer, J. & Vinderola, G. Use of cheese whey for biomass production and spray drying of probiotic lactobacilli. J. Dairy Res. 81, 267–74 (2014).
21. Golowczyc, M. et al. Use of whey permeate containing in situ synthesised galacto-oligosaccharides for the growth and preservation of Lactobacillus plantarum. J. Dairy Res. 80, 374–81 (2013).
22. Padilla, B. et al. Production of lactulose oligosaccharides by isomerisation of transgalactosylated cheese whey permeate obtained by ?-galactosidases from dairy Kluyveromyces. J. Dairy Res. 82, 356–364 (2015).
23. Geiger, B. et al. From by-product to valuable components: Efficient enzymatic conversion of lactose in whey using?beta-galactosidase from Streptococcus thermophilus. Biochem. Eng. J. 116, 45–53 (2016).
24. Guimarães, P. M. R., Teixeira, J. A. & Domingues, L. Fermentation of lactose to bio-ethanol by yeasts as part of integrated solutions for the valorisation of cheese whey. Biotechnology Advances 28, 375–384 (2010).
25. Peters, R. H. Economic aspects of cheese making as influenced by whey processing options. in International Dairy Journal 15, 537–545 (2005).
26. Koutinas, A. A. et al. Whey valorisation: A complete and novel technology development for dairy industry starter culture production. Bioresour. Technol. 100, 3734–3739 (2009).
27. Gonzalez Siso, M. I. The biotechnological utilization of cheese whey: A review. Bioresource Technology 57, 1–11 (1996).
28. Kotoupas, A., Rigas, F. & Chalaris, M. Computer-aided process design, economic evaluation and environmental impact assessment for treatment of cheese whey wastewater. Desalination 213, 238–252 (2007).
29. Ramos, O. L. et al. Whey and Whey Powders: Production and Uses. Encycl. Food Heal. 5, 498–505 (2016).
30. Sp?l??elu (Vicol), C. Biotechnological valorisation of whey. Innov. Rom. Food Biotechnol. 10, 1–8 (2012).
31. Bednarski, W. Possibilities for whey utilization. Przem. Ferment. i Owocowo-Warzywny 32, 14–17 (1988).
32. Grosu, L. et al. Valorization of whey from dairy industry for agricultural use as fertiliser: Effects on plant germination and growth. Environ. Eng. Manag. J. 11, 2203–2210 (2012).
33. Smithers, G. W. et al. New Opportunities from the Isolation and Utilization of Whey Proteins. J. Dairy Sci. 79, 1454–1459 (1996).
34. Božani?, R., Baruk?i?, I. & Lisak, K. Possibilities of whey utilisation. J. Nutr. Food Sci. 2, 1–7 (2014).
35. Jayaprakasha, H. M. & Brueckner, H. Whey Protein Concentrate: A Potential Functional Ingredient for Food Industry. J. Food Sci. Technol. 36, 189–204 (1999).
36. Jeewanthi, R. K. C., Lee, N.-K. & Paik, H.-D. Improved Functional Characteristics of Whey Protein Hydrolysates in Food Industry. Korean J. Food Sci. Anim. Resour. 35, 350–359 (2015).
37. Gernigon, G., Schuck, P., Jeantet, R. & Burling, H. in Encyclopedia of Dairy Sciences 738–743 (2011). doi:10.1016/B978-0-12-374407-4.00496-9
38. Ramchandran, L. & Vasiljevic, T. in Membrane Processing: Dairy and Beverage Applications 193–207 (2012). doi:10.1002/9781118457009.ch9
39. Kjaergaard-Jensen, G. & Oxlund, J. K. in Trends in Utilization of Whey and Whey Derivatives 21 (Bull. 233, IDF, 1988).
40. Mawson, A. J. Bioconversions for whey utilization and waste abatement. Bioresour. Technol. 47, 195–203 (1994).
41. Booij, C. J. Use of lactose in the pharmaceutical and chemical industry. J. Soc. Dairy Technol. 38, 105–109 (1985).
42. Zadow, J. G. Lactose: Properties and Uses. J. Dairy Sci. 67, 2654–2679 (1984).
43. Paterson, A. H. J. in Advanced Dairy Chemistry 3, 105–120 (2009).
44. Wee, Y., Kim, J. & Ryu, H. Biotechnological Production of Lactic Acid and Its Recent Applications. Food Technology and Biotechnology 44, 163–172 (2006).
45. Litchfield, J. H. in Encyclopedia of Microbiology 362–372 (2009). doi:http://dx.doi.org/10.1016/B978-012373944-5.00151-6
46. Wasewar, K. L. Separationof Lactic Acid?: RecentAdvances. Chem. Biochem. Eng. Q. 19, 159–172 (2005).
47. Roukas, T. & Kotzekidou, P. Lactic acid production from deproteinized whey by mixed cultures of free and coimmobilized Lmtobacillus casei and Lmtococcus Zactis cells using fedbatch culture. Enzyme Microb. Technol. 22, 199–204 (1998).
48. Panesar, P. S., Kennedy, J. F., Gandhi, D. N. & Bunko, K. Bioutilisation of whey for lactic acid production. Food Chemistry 105, 1–14 (2007).
49. Fuquay, J. W. & Jelen, P. in Encyclopedia of Dairy Sciences 731–737 (2011). doi:http://dx.doi.org/10.1016/B978-0-12-374407-4.00495-7
50. Alvarez, M. M., Aguirre-Ezkauriatza, E. J., Ramírez-Medrano, A. & Rodríguez-Sánchez, Á. Kinetic analysis and mathematical modeling of growth and lactic acid production of Lactobacillus casei var. rhamnosus in milk whey. J. Dairy Sci. 93, 5552–5560 (2010).
51. Stieber, R. W. & Gerhardt, P. Continuous Process for Ammonium-Lactate Fermentation of Deproteinized Whey. J. Dairy Sci. 62, 1558–1566 (1979).
52. Panesar, P. S., Kennedy, J. F., Knill, C. J. & Kosseva, M. Production of L(+) Lactic Acid using Lactobacillus casei from Whey. Brazilian Arch. Biol. Technol. 53, 219–226 (2010).
53. Norton, S., Lacroix, C. & Vuillemard, J. C. Kinetic study of continuous whey permeate fermentation by immobilized Lactobacillus helveticus for lactic acid production. Enzyme and Microbial Technology 16, 457–466 (1994).
54. Roukas, T. & Kotzekidou, P. Production of lactic acid from deproteinized whey by coimmobilized Lactobacillus casei and Lactococcus lactis cells. Enzyme Microb. Technol. 13, 33–38 (1991).
55. Kosseva, M. R., Panesar, P. S., Kaur, G. & Kennedy, J. F. Use of immobilised biocatalysts in the processing of cheese whey. International Journal of Biological Macromolecules 45, 437–447 (2009).
56. Aguirre-Ezkauriatza, E. J., Aguilar-Yáñez, J. M., Ramírez-Medrano, A. & Alvarez, M. M. Production of probiotic biomass (Lactobacillus casei) in goat milk whey: Comparison of batch, continuous and fed-batch cultures. Bioresour. Technol. 101, 2837–2844 (2010).
57. Fooks, L. J., Fuller, R. & Gibson, G. R. Prebiotics, probiotics and human gut microbiology. Int. Dairy J. 9, 53–61 (1999).
58. Chen, L. A. & Sears, C. L. in Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases 1, 19–25 (2014).
59. Babu, M. production ofsingle cell protein using kluveromyces marxianus isolated form paneer whey. Int. J. Biomed. Adv. Res. 5, 79–80 (2014).
60. Koushki, M., Jafari, M. & Azizi, M. Comparison of ethanol production from cheese whey permeate by two yeast strains. J. Food Sci. Technol. 49, 614–619 (2012).
61. Fonseca, G. G., Heinzle, E., Wittmann, C. & Gombert, A. K. The yeast Kluyveromyces marxianus and its biotechnological potential. Applied Microbiology and Biotechnology 79, 339–354 (2008).
62. Lane, M. M. & Morrissey, J. P. Kluyveromyces marxianus: A yeast emerging from its sister’s shadow. Fungal Biology Reviews 24, 17–26 (2010).
63. Gabardo, S., Rech, R., Rosa, C. A. & Ayub, M. A. Z. Dynamics of ethanol production from whey and whey permeate byimmobilized strains of Kluyveromyces marxianus in batch andcontinuous bioreactors. Renew. Energy 69, 89–96 (2014).
64. Gupta, A. & Srivastava, A. K. Continuous Propionic Acid Production from Cheese Whey Using In Situ Spin Filter. Biotechnol. Bioprocess Eng 6, 1–5 (2001).
65. Jain, D. K., Tyagi, R. D., Kluepfel, D. & Agbebavi, T. J. Production of propionic acid from whey ultrafiltrate by immobilized cells of Propionibacterium shermanii in batch process. Process Biochem. 26, 217–223 (1991).
66. Alam, S., Stevens, D. & Bajpai, R. Production of butyric acid by batch fermentation of cheese whey withClostridium beijerinckii. J. Ind. Microbiol. 2, 359–364 (1988).
67. Arslan, N. P., Aydogan, M. N. & Taskin, M. Citric acid production from partly deproteinized whey under non-sterile culture conditions using immobilized cells of lactose-positive and cold-adapted Yarrowia lipolytica B9. J. Biotechnol. 231, 32–39 (2016).
68. Raganati, F. et al. Butanol production by bioconversion of cheese whey in a continuous packed bed reactor. Bioresour. Technol. 138, 259–265 (2013).
69. Qureshi, N., Friedl, A. & Maddox, I. S. Butanol production from concentrated lactose/whey permeate: Use of pervaporation membrane to recover and concentrate product. Appl. Microbiol. Biotechnol. 98, 9859–9867 (2014).
70. Farnworth, E. R. Kefir – a complex probiotic. Food Sci. Technol. Bull. Funct. Foods 2, 1–17 (2005).
71. Nielsen, B., Gürakan, G. C. & Ünlü, G. Kefir: A Multifaceted Fermented Dairy Product. Probiotics and Antimicrobial Proteins 6, 123–135 (2014).
72. Gradova, N. B., Khokhlacheva, A. A., Murzina, E. D. & Myasoyedova, V. V. Microbial components of kefir grains as exopolysaccharide kefiran producers. Appl. Biochem. Microbiol. 51, 873–880 (2015).
73. Frengova, G. I., Simova, E. D., Beshkova, D. M. & Simov, Z. I. Exopolysaccharides produced by lactic acid bacteria of kefir grains. Zeitschrift fur Naturforsch. - Sect. C J. Biosci. 57, 805–810 (2002).
74. Maeda, H., Zhu, X., Omura, K., Suzuki, S. & Kitamura, S. Effects of an exopolysaccharide (kefiran) on lipids, blood pressure, blood glucose, and constipation. Biofactors 22, 197–200 (2004).
75. Rodrigues, K. L., Carvalho, J. C. T. & Schneedorf, J. M. Anti-inflammatory properties of kefir and its polysaccharide extract. Inflammopharmacology 13, 485–492 (2005).
76. Pop, C. et al. Influence of Different Growth Conditions on the Kefir Grains Production, used in the Kefiran Synthesis. Bull. UASVM Food Sci. Technol. 71, 2344–2344 (2014).
77. Yokoi, H. et al. Some taxonomical characteristics of encapsulated Lactobacillus sp. KPB-167B isolated from kefir grains and characterization of its extracellular polysaccharide. Int. J. Food Microbiol. 13, 257–264 (1991).
78. Piermaria, J. A., de la Canal, M. L. & Abraham, A. G. Gelling properties of kefiran, a food-grade polysaccharide obtained from kefir grain. Food Hydrocoll. 22, 1520–1527 (2008).
79. Shahabi-Ghahfarrokhi, I., Khodaiyan, F., Mousavi, M. & Yousefi, H. Effect of ?-irradiation on the physical and mechanical properties of kefiran biopolymer film. Int. J. Biol. Macromol. 74, 343–350 (2015).
80. Piermaria, J. et al. Kefiran films plasticized with sugars and polyols: water vapor barrier and mechanical properties in relation to their microstructure analyzed by ATR/FT-IR spectroscopy. Food Hydrocoll. 25, 1261–1269 (2011).
81. Dailin, D. J. et al. Bioprocess development for kefiran production by Lactobacillus kefiranofaciens in semi industrial scale bioreactor. Saudi J. Biol. Sci. 23, 495–502 (2016).
82. Illanes, A. in Lactose-Derived Prebiotics: A Process Perspective 1–33 (2016). doi:10.1016/B978-0-12-802724-0.00001-9
83. Vera, C., Guerrero, C., Conejeros, R. & Illanes, A. Synthesis of galacto-oligosaccharides by ?-galactosidase from Aspergillus oryzae using partially dissolved and supersaturated solution of lactose. Enzyme Microb. Technol. 50, 188–194 (2012).
84. Fischer, C. & Kleinschmidt, T. Synthesis of galactooligosaccharides using sweet and acid whey as a substrate. Int. Dairy J. 48, 15–22 (2015).
85. Kovacs, Z. et al. Recent developments in manufacturing oligosaccharides with prebiotic functions. Adv. Biochem. Eng. Biotechnol. 143, 257–295 (2013).
86. Torres, D. P. M., Gonçalves, M. do P. F., Teixeira, J. A. & Rodrigues, L. R. Galacto-Oligosaccharides: Production, properties, applications, and significance as prebiotics. Compr. Rev. Food Sci. Food Saf. 9, 438–454 (2010).
87. Scott, F., Vera, C. & Conejeros, R. Chapter 7 – Technical and Economic Analysis of Industrial Production of Lactose-Derived Prebiotics With Focus on Galacto-Oligosaccharides. Lactose-Derived Prebiotics (2016). doi:10.1016/B978-0-12-802724-0.00007-X
88. Neto, H. B. D. A. et al. Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations. Appl. Environ. Microbiol. 4, 1–6 (2009).
89. Rodríguez Colinas. obtención enzimática, caracterización y propiedades prebióticas de oligosacáridos empleados en leches infantiles. (Universidad Autónoma de Madrid (UAM), 2013).
90. Petrides, D. Bioprocess Design and Economics. Bioseparations Science and Engineering (2013).
91. Peters, M. S. & Timmerhaus, K. D. Plant design and economics for chemical engineers. Plant Design and Economics for Chemical Engineers (2004).
92. Schultz, N., Chang, L., Hauck, A., Reuss, M. & Syldatk, C. Microbial production of single-cell protein from deproteinized whey concentrates. Appl. Microbiol. Biotechnol. 69, 515–520 (2006).
Recibido: 21 julio 2017
Aprobado: 20 agosto 2017
José M. Pais Chanfrau1*, Jimmy Núñez Pérez1, Marco V. Lara Fiallos1, Leonor M. Rivera Intriago2,3, Luis E. Trujillo Toledo4, Milton J. Cuaran Guerrero1.
1 Grupo de Investigación de Lácteos (GILAC). Facultad de Ingeniería en Ciencias Agropecuarias y Ambientales (FICAYA). Universidad Técnica del Norte (UTN). Ave. 17 de julio, 5-21, y Gral. José Ma. de Córdova, CP 100105, Ibarra, Imbabura, Ecuador. ([email protected])
2 Universidad Técnica de Machala, Machala, El Oro, Ecuador.
3 Unidad de Post-grado de la Universidad Nacional Mayor de San Marcos-Perú.
4 Industrial Biotechnology and Bioproducts Research Group, Center for Nanoscience and Nanotecnology, CENCINAT, Universidad de las Fuerzas Armadas (ESPE), Ave. Rumiñahui s/n. Quito, Pichincha, Ecuador.