2022.07.02.25
Files > Volume 7 > Vol 7 No 2 2022
1. Facultad de Ingeniería Agronómica, Universidad Técnica de Manabí, Campus Experimental La Teodomira, Km 13, Lodana, Santa Ana, Manabí.
*Address for correspondence:
Prof. Felipe R. Garcés-Fiallos, Ph.D.,
Facultad de Ingeniería Agronómica,
Universidad Técnica de Manabí,
Portoviejo EC130105, Manabí,
ECUADOR
Mobile: +593 939929958
Email: [email protected]
Available from: http://dx.doi.org/10.21931/RB/2022.07.02.25
RESUMEN
Phytophthora capsici es un oomiceto causante de la pudrición de raíz, tallo, frutos y tizón foliar en varias especies vegetales de importancia agrícola, principalmente en Solanáceas del género Capsicum como ají y pimiento. Este fitopatógeno cosmopolita posee mecanismos de ataque que favorecen la rápida infección, colonización y reproducción en huéspedes susceptibles. Contrariamente, estos procesos son retrasados o evitados fuertemente por genotipos resistentes, debido principalmente a sus mecanismos de defensa. En esas interacciones incompatibles, las plantas resistentes de Capsicum reconocen el oomiceto y rápidamente expresan múltiples genes que posteriormente señalizan moléculas, que permiten la acumulación de compuestos fenólicos, fitoalexinas y especies reactivas de oxígeno, la actividad de diferentes enzimas, que pueden permitir incluso la formación de barreras físicas. Esta revisión aborda, expone y discute los avances y el progreso de las investigaciones a lo largo de los ultimos veinte años, referente a los mecanismos de defensa estructurales, bioquimicos y moleculares que utilizan las plantas resistentes de Capsicum para defenderse de P. capsici.
Palabras claves. ají, pimiento, pudrición de raíz y corona, tizón foliar, resistencia vegetal
ABSTRACT
Phytophthora capsici is an oomycete that causes root, stem and fruit rot, and leaf blight in several plant species of agricultural importance, mainly in Solanaceae of the genus Capsicum as chili pepper and pepper. This cosmopolitan plant pathogen has attack mechanisms that favor a fast infection, colonization, and reproduction in susceptible hosts. In contrast, these processes are strongly delayed or avoided in resistant genotypes, mainly due to their effective defense mechanisms. In these incompatible interactions, the resistant plants of Capsicum recognize the oomycete and rapidly express multiple genes that subsequently signal molecules, which allow the accumulation of phenolic compounds, phytoalexins, and reactive oxygen species, activity of different enzymes, which can even allow the formation of physical barriers. This review address exposes and discusses the advances and progress of research over the last twenty years regarding the structural, biochemical, and molecular defense mechanisms Capsicum resistant plants use to defend against P. capsici.
Keywords. chili pepper, pepper, root and crown rot, leaf blight, plant resistance
INTRODUCCIÓN
Phytophthora capsici es un oomiceto descrito en 1992 por Leonian1, causando pudrición de raíz y tallo en plantas de ají (Capsicum chinense Jacq.). Desde su reporte, ha expandido su rango de hospederos hasta superar las 70 especies vegetales que incluyen Solanaceas del género Capsicum (C. baccatum, C. chinense Jacq. y C. frutescens L y C. annuum L)2,3. En condiciones ambientales favorables, las enfermedades causadas por P. capsici pueden reducir totalmente la producción de frutos4. Además, el patógeno puede sobrevivir en ausencia del huésped, mediante la producción de oosporas, estructuras de hibernación que forman el inóculo primario y así iniciar la infección en plantas susceptibles5. Las plantas infectadas presentan amarillamiento y marchitamiento repentino en hojas, al limitarse la absorción y transporte de agua, producto de la destrucción del sistema radicular (pudrición)6. De igual manera, tallos, y frutos también pueden verse afectados7, por lo que el complejo manejo del oomiceto deriva en el uso de fungicidas (oomiceticidas) de forma indiscriminada, afectando esta práctica negativamente el agroecosistema a largo plazo. Así, el uso de genotipos resistentes se vislumbra como la estrategia más conveniente y eficaz para el control de la pudrición de raíz y cuello (PRC)8. Hasta hace algunos años atrás, se conocía la presencia de fuentes de resistencia a P. capsici únicamente en variedades criollas de pimiento CM334 y de ají habanero criollo naranjal9,10.
En la actualidad, existe evidencia de resistencia al oomiceto en diferentes genotipos criollos y comerciales de Capsicum en algunos países del mundo como México11 y Ecuador3, que son poco o nada afectados por el patógeno, mostrando incluso una tenue colonización de tejidos de la raíz y del hipocótilo. La interacción entre plantas y fitopatógenos son asociaciones complejas que se caracterizan por el reconocimiento de patrones moleculares asociados a patógenos por parte del sistema inmunológico de una planta y las respuestas posteriores por efectores secretados codificados por patógenos12,13. En Capsicum, el exiguo avance del patógeno en sus tejidos, podría resultar de la activación de mecanismos de defensa como la acumulación de compuestos fenólicos14, actividad de peroxidasa y fenilalanina amonio-liasa15,16, contenido de lignina y biosíntesis de fitoalexinas15, acumulación de transcritos9, formación de barreras físicas17,18, entre otros.
Las fuentes de resistencia y el conocimiento de la interacción entre Capsicum spp. y P. capsici, mejorarían notablemente la durabilidad de esta en los genotipos resistentes, principalmente en condiciones de campo3. Aunque existe información científica sobre mejoramiento genético de Capsicum spp., los mecanismos de defensa relacionados a la resistencia a P. capsici han sido abordados con poca frecuencia, exeptuando algunos trabajos que han sido cubiertos en esta revisión como los de Castro, Fernández, y Osuna19 y Chávez-Díaz y Zavaleta-Mejía20, que exploran los mecanismos de defensa y la comunicación molecular en el patosistema Capsicum spp. - P. capsici.
Esta revisión aborda, expone y discute los avances y el progreso de las investigaciones a lo largo de los ultimos veinte años, relacionado especificamente a los mecanismos de defensa bioquimicos, fisicos y moleculares, usados por plantas de Capsicum spp. para defenderse de Phytophthora capsici.
Etiología
Phytophthora capsici, taxonómicamente pertenece al Reino Chromista, Phylum Oomycota, Clase Oomycetes, Orden: Peronosporales, y Familia Peronosporaceae10, ubicándose en el clado número 2, dentro de los diez propuestos para Phytophthora en el 2008 por Blair21, guardando estrecha relación filogenética con otras especies como P. mexicana, P. tropicalis y la nueva especie P. sp. “glovera”. El patógeno posee micelio cenocítico y produce zoosporangios ovoides, elipsoides y papilados que contienen zoosporas reniformes y biflageladas10,22, que pueden ser liberados rápidamente, aislados o agrupados, cuando están bajo estrés térmico23. Este oomiceto también produce un gametangio masculino (anteridio) y otro femenino (oogonio), con los que mediante meiosis forman oosporas (esporas sexuales), que pueden servir como estructura de hibernación24. Aproximadamente la mitad de las especies del género Phytophthora son homotálicas o auto fértiles, mientras que las restantes como P. capsici son heterotálicas, lo que contribuye al proceso de recombinación genética entre especies de Phytophthora, como, se describe entre P. capsici y P. drechsleri, en Petunia x hybrida como hospedero25,26.
Sintomatología
Los síntomas observados en varios órganos y en diferentes etapas fenológicas vegetativas o reproductivas (Figura 1), pueden estar asociados a la agresividad de P. capsici, a los niveles de resistencia del genotipo, y a las condiciones climáticas i.e. clima cálido y húmedo, temperaturas entre 25 y 30 °C y humedad relativa entre 60 a 80%2,27. El oomiceto puede afectar prácticamente todos los órganos de ají o pimiento25,28,29,6.
Entre los síntomas observados están las lesiónes distintivas de color negro-marrón tanto en raices (Figura 1A) como en la corana (cuello, Figura 1B), pudiendo incluso visualizarce lesiones empapadas de agua en esta última región. Una vez que los tallos de las plantas son infectados, se desarrolla un marchitamiento irreversible que comienza en el follaje, propagándose luego a la parte aérea de la planta (Figura 1C). Todas estas afectaciones derivan en la muerte anticipada de las plantas (Figura 1D). En las hojas pueden observarse pequeñas manchas de color verde oscuro, que a medida que avanza la infección se agrandan y se decoloran, denominándose este síntoma como tizón foliar (Figura 1E). Mientras tanto, los frutos infectados al inicio muestran una coloracion verda oscura, que posteriormente se tornan marrón con manchas oscuras acuosas cubiertas de micelio y esporas de color blanco del patógeno (Figura 1E).

Figura 1. Síntomas de pudrición de raíz (A) y tallo (B), marchitez (C) y muerte (D) en plantas, tizón foliar (E), y pudrición de frutos (F), en Capsicum spp. causados por Phytophthora capsici, en condiciones controladas (A, B, E y F) y de campo (C y D).
Mecanismos de defensa en Capsicum spp.
Durante el proceso evolutivo los fitopatógenos han desarrollado mecanismos para obtener nutrientes de su hospedante. En respuesta, las plantas presentan barreras físicas (figura 3), químicas y moleculares (figura 4) para dificultar el progreso de esos microorganimos20, desarrollando la capacidad de reconocer Patrones Moleculares Asociados al Daño (DAMP), así como a Microbios o Patógenos (MAMP o PAMP, respectivamente), a través de Receptores de Reconocimiento de Patrones (PRRs) localizados en la membrana celular12,13. P. capsici secreta efectores (proteinas o moléculas) citoplasmáticos durante la infección del huesped, para manipular su fisiología y defensa, como las proteinas crinkler (CRN) y la quitina (polisacárido), que se trasladan a las células vegetales, para alcansar exclusivamente el núcleo del huesped12,30. La familia de proteinas CRN pueden modificar la señalización de la célula huésped en sus distintos compartimentos subnuclares, poseyendo una importancia en la patogénesis de los oomicetos en las plantas, participando en la muerte celular inducida por PAMP y aumentando la virulencia de P. capsici13. Por otro lado, la quitina, componente habitual de la pared celular de hongos verdaderos, puede estar presente en zoosporas y esporangios liberados de P. capsici, empleandose como un PAMP sobre Arabidiopsis thaliana30.
Otros efectores como el PcAvh1 induce la muerte celular no solo en pimiento morrón, sino tambien en Nicotiana benthamiana y tomate31. Así mismo, el RxLR48 facilita la infección suprimiendo incluso la señalización de ácido salicílico (SA) y de la inmunidad activada por patrones (PTI) en A. thaliana32. Otro efector como PcAvh103, puede facilitar la infección mediante la supresión de la inmunidad de la planta, siendo necesario para la virulencia de P. capsici33.
En una interacción incompatible, genotipos resistentes de Capsicum tienen la capacidad de retrasar o evitar el crecimiento de P. capsici en sus tejidos8. Como resultado, las plantas presentan síntomas imperceptibles, o casi nulos tanto interna como externamente, en tejidos subterraneos o aereos, debiendose, posiblemente a que el oomiceto llega con un retraso considerable a los tejidos superiores como hipocótilos3. Así la colonización y los síntomas producidos por P. capsici es mayor e intensa en tejidos susceptibles comparado con los resistentes (Figura 2).
Los posibles mecanismos bioquímicos, físicos y moleculares usados por plantas resistentes de ají o pimiento para defenderse de P. capsici son descritos a seguir.

Figura 2. Síntomas de amarillamiento tenue en hojas bajeras (A), marchitamiento generalizado (B), y colonización de hipocótilos (C y D) en plantas resistentes (A y C) y susceptibles (B y D) de pimiento a los 17 días despúes de la inoculación con Phytophthora capsici.
Mecanismos estructurales (físicos)
Estos mecanismos son la primera barrera en la defensa vegetal, apoyados por el reconocimiento genético y la activación de compuestos bioquímicos, que producen cambios estructurales para fortalecer los tejidos en órganos afectados por P. capsici, derivando en una serie de eventos con la finalidad de detener o reducir la infección del oomiceto (Figura 3).
Refuerzo de la pared celular
La cutícula es la primera barrera física que presentan las plantas para contrarrestar los fitopatógenos. Esta capa protectora situada en la superficie más externa en las partes aéreas de plantas superiores está constituida principalmente de los polímeros lipofílicos cutina y ceras cuticulares, los cuales son alterados tanto en su composición como ultraestructura por factores genéticos, fisiológicos y ambientales4. Aunque el refuerzo de la cutícula es un mecanismo físico presentado por las plantas para frenar el avance de la infección de fitopatógenos, organismos hemibiotrofos como P. capsici podrían fácilmente superar esta barrera y continuar con la infección5,18.
Ante esto es posible el reforzamiento o endurecimiento de la pared celular especialmente de celulas epidérmicas, mediante la acción de multiples enzimas como las peroxidasas (POX), que sintetizan compuestos como lignina y suberina, generando rigidez en las paredes celulares y téjidos, frenando el progreso de la infección de P. capsici en getipos resistentes (Figura 3)19. Además, el engrosamiento o formación de paredes de la periderme (producida ante heridas), formados entre la parte inferior de las células epidérmicas y superior de las células corticales de Capsicum, resulta en un aumento del grosor de la laminilla media, evitando la colonización cortical por parte del oomiceto (Figura 3)17. Finalmente, aunque el polisacárido calosa o callosa sea un mecanismo bioquímico, su acumulación en células vasculares y medulares puede blindarlas, frenando el avanace de P. capsici (Figura 3)18.
Formación de aposiciones
Una de las características estructurales más prominentes en plantas resistentes son la formación de aposiciones (papilas) en la pared celular, localizadas en el sitio de infección de P. capsici. Estas papilas gruesas y densas encierran al haustorio del oomiceto restringiendo su desarrollo y penetración en los tejidos (Figura 3)36. En algunas ocasiones se ha podido observar daño celular del oomiceto dentro aposiciones, sugiriendo que este mecanismo además de blindar a la célula, pueden estar compuestas de enzimas como β-glucanasas (GLU) y quitinasas (CHI), conocidas por degradar la pared celular de fitopatógenos20.
Producción de exudados
Las paredes celulares de raíces de genotipos susceptibles son parcialmente degradadas estructuralmente por la acción enzimática de P. capsici. En contraste, en tejidos resistentes el fitopatógeno es atrapado por exudados radicales en la rizodermis de raíces, compuestos de proteínas y polisacáridos, que se acumularían cerca de la laminilla media de células rizodérmicas, permitiendo no solo el control de microrganismos nocivos sino también la comunicación con plantas vecinas (Figura 3)17. De cualquier manera, la cantidad del patógeno en tejidos radiculares no siempre se correlaciona con la resistencia o susceptibilidad en Capsicum. De hecho, en un trabajo reciente donde se estudió la colonización de tejidos por P. capsici, empleando herramientas convencionales y moleculares se encontró que el patógeno coloniza de forma más intensa los tejidos subterraneos resistentes que los susceptibles, mientras que en tejidos del hipocótilo fue lo opuesto3.
Resistencia relacionada con la edad
Este mecanismo puede ser observado tanto en plantas28 como en frutos37. En plantas, la susceptibilidad a la enfermedad puede estar relacionada con la edad de las plantas, es decir, plantas adultas son más resistentes que las jóvenes, debido principalmente a la dureza de los tejidos por el aumento de la lignificación. En el caso de frutos, la susceptibilidad disminuye al aumentar la etapa de maduración (senescencia), debido a que la cutícula de frutos rojos es mucho más gruesa que la de los verdes, constituyendo un factor de resistencia estructural contra P. capsici. Este engrosamiento es correlacionado por el aumento de POX, contribuyendo con la polimerización de compuestos similares a la lignina, y formando una barrera ante la infección (Figura 3). En frutos de otros cultivos como calabaza (Cucurbita duchesne), generalmente muy susceptible a P. capsici, se ha observado una alta correlación entre la formación de una cutícula y epidermis gruesas en frutos maduros38.
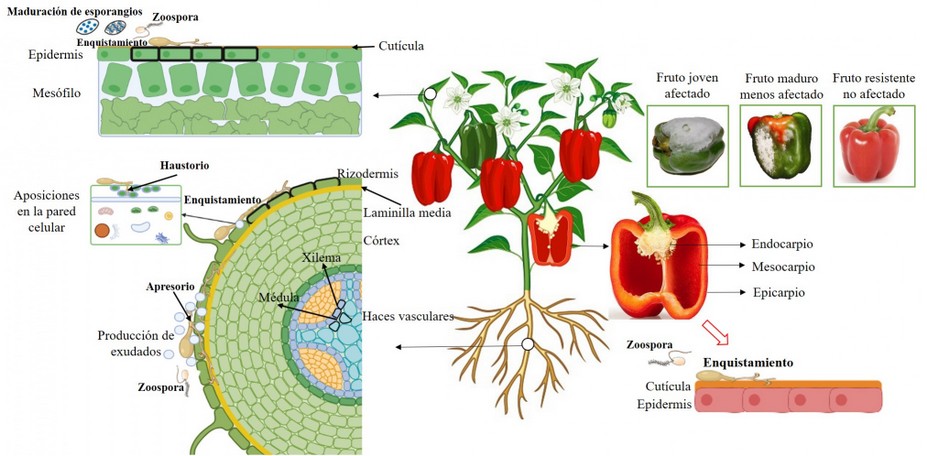
Figura 3. Mecanismos de defensa estructurales (físicos) en plantas de Capsicum spp. contra Phytophthora capsici. Defensa física de la celula por el engrosamiento de la pared celular en la epidermis y rizodermis20. Aumento de la laminilla media entre las células epidérmicas y corticales para limitar el avance de las hifas del fitopatógeno17. Formación de aposiciones (papilas) en células rizodermicas que encierran el haustorio de P. casici, limitando su movilidad e incluso degradando sus estructuras36. Producción de exudados radiculares compuestos de proteínas y polisacáridos que reprimen el desarrollo de la infección por el oomiceto17. Resistencia asociada a la edad en frutos maduros debido al aumento del grosor de la cutícula37.
Mecanismos bioquímicos
Las plantas pueden responder al ataque de fitopatógenos, mediante la producción de sustancias enzimáticas o precursores y sus productos, especies reactivas de oxígeno, fitoalexinas y hormonas. Estas sustancias logran crear un ambiente altamente tóxico, o a su vez intervienen en la deposición del refuerzo de la pared celular, formando parte de la barrera mecánica frente a fitopatógenos39.
Capsidiol
El capsidiol (sesquiterpno antifúngico, C15H24O2) es una fitoalexina aislada por primera vez a partir de frutos de pimiento infectados por diversos fitopatógenos40, siendo producida en diferentes especies de Capsicum, y formada tanto en la vía Isoprenoide a partir de genes biosintéticos EAS (5-epi-aristolochene sintasa) y de enzimas como hidroximetilglutaril-CoA reductasa (HMGR, EC:1.1.1.34), así como en la vía del mevalonato (ácido mevalónico) donde participan los genes HMGR241,42 (Figura 4). En frutos de pimiento, el capsidiol también puede ser inducido por el tratamiento exógeno de peróxido de hidrógeno (H2O2), junto con una respuesta que incluye la producción de especies reactivas de oxígeno (ROS)43.
La fitoalexina puede ser fungitástica o fungitóxica a niveles de 3,8 o <5 mM, siendo esta concentración equivalente a 1180 µg de capsidiol mL-1, correspondiendo aproximadamente a la concentración observada a los 6 dias despues de la inoculación (DPI) con P. capsici (204 µg mL-1), en el área necrosada del genotipo resistente de pimiento Smith-5 (Figura 5). De igual manera, el genotipo CM334 presenta concentraciones elevadas de capsidiol a las 12 y 24 horas posterior a la inoculación (HPI) con el oomiceto15.
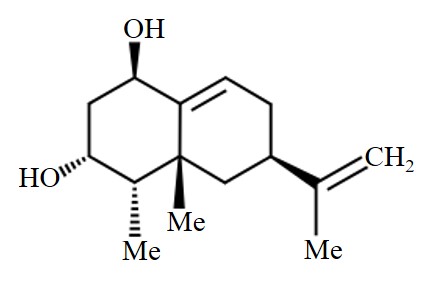
Figura 4. Estructura de la fitoalexina capsidiol, un sesquiterpeno encontrado en tejidos de Capsicum spp.
Calosa
La calosa es un polisacárido producido principalmente en los plasmodesmos de células vegetales a partir de la enzima Calosa sintasa (CalS, EC 2.4.1.34), para blindar la pared y frenar el avanace de P. capsici en las células vasculares y medulares, reflejandose daños menores en plantas resistentes debido a su deposición, sirviendo además en la comunicación celular por su acumulación cercana a los sitios de interconección celular (Figura 5)18, 44. En trabajos como el de Piccini et al. (2019)18, se observó una deposición de este polisacárido únicamente en células xilemáticas de plantas resistentes, infectadas y no infectadas por P. capsici. sugiriendo ser un importante mecanismo de defensa/resistencia contra el oomiceto.
Enzimas involucradas en la biosintesis de compuestos fenólicos
La pared celular vegetal es una estructura compleja que actúa como una barrera física, restringiendo el acceso a la mayoría de microbios hacia el interior de la célula, debido principalmente a la acumulacion de compuestos fenólicos como la lignina, polímero hidrófobo de monolignoles sintetizados en el citoplasma y transportados al apoplasto, cuya funcion es dar duresa y rigidez a la pared celular, sintetizada por la activación de enzimas45. Por lo general, el nivel de enzimas aumenta en tejidos vegetales para contrarestar la infección de fitopatógenos vehiculados por el suelo46.
Peroxidasas
El grupo de las peroxidasas (POX, EC 1.11.1.14) como guayacol peroxidasa (GPX, EC 1.11.1.7), ascorbato peroxidasa (APX, EC 1.11.1.11)46, entre otras, son las principales enzimas presentes en el sistema antioxidante de plantas, transformando varios compuestos en productos oxidados o polimerizados, como la lignina (Figura 5), a partir de la sintesis de mognolignoles mediante actividad redox (H2O2 + 2AH2 + H2O + 2. AH)47. En tallos y hojas de plantas resistentes de ají a P. capsici, se ha observado el constante incremento de POX a los 2 DPI, elevándose su actividad 36 % más a los 6 DPI. El aumento de la actividad de POX es tanto a nivel extracelular como en la pared celular, indicando un papel clave en la resistencia local y sistémica en Capsicum contra P. capsici48,49.
Polifenol Oxidasa
Polifenol Oxidasa (PPO, EC 1.14.18.1) está involucrada en la lignificación, la oxidación de compuestos fenólicos existentes y su posible esterificación en la pared celular durante la invasión de fitopatógenos hemibiotrofos (Figura 5), participando además en la respuesta de defensa hipersensible50,51. En raíces de Capsicum, puede observarse un incremento de la actividad de PPO a los 3 DPI con P. capsici como una respuesta temprana de la infección. Además, como resultado del ataque del patógeno existe una ruptura de la membrana que puede también inducir la formación de quininas (alcaloide antimicrobiano)48.
Fenilalanina amonio liasa
La fenilalanina amonio liasa (PAL, EC 4.3.1.5) es una enzima clave involucrada tanto en el primer paso de la vía de fenilpropanoides que convierte la L-fenilalanina en ácido transcinámico52, como en la biosíntesis de fenoles, conduciendo principalmente a la producción de lignina en las células vegetales. La actividad de PAL puede aumentar en raíces, hojas y tallos de plantas resistentes de Capsicum a los 2 o 3 DPI con P. capsici16,53. Inclusive se ha comprobado un aumento de los niveles de compuestos fenólicos y de la actividad enzimática de su precursor PAL (figura 5) al sexto DPI con el oomiceto49,54.
Enzimas antimicrobianas (β-1,3-glucanasa y quitinasa)
La enzima β-1,3-glucanasa (GLU, EC 3.2.1.39) hidroliza las paredes celulares de patógenos fúngicos comúnmente en combinación con otra enzima, la quitinasa (CHI; EC 3.2.1.14)55, y pertenecen al grupo de proteinas PR (PR2 and PR3, respectivamente). La enzima GLU inhibe el crecimiento micelial (Figura 5) y la formación de esporangios de P. capsici en plantas resistentes como CM334, detectándose concentraciones máximas de 77.2 µg a las 24 HPI, mediante la degradación de glucanos (β-1,3-glucanos) presentes en la pared celular del oomiceto, y que actúan como una MAMP que desencadenan la defensa basal de la planta56,57 (Figura 5). De hecho, una acumulación temprana y rápida de GLU está asociada con la reacción de defensa que se desarrolla en tallos de pimiento infectados con P. capsici58. Incluso esta enzima puede actuar sinergicamente con otras para defenderse de oomicetos, por ejemplo, con PAL para inhibir el crecimiento micelial y la formación de esporangios del oomiceto56.
Por otro lado, la quitinasa (EC 3.2.11.14) CaChiIV3 encontrada en tejidos de pimiento cv. Yanshan01, además de estar relacionada con β-1,3-glucanasa, esta enzima es producida por la planta para degradar la quitina de la pared celular de P. capsici, o funcionar como un receptor, desencadenando respuestas de defensa en la planta59.
Otras enzimas vegetales
Transglucaminasas
Las transglucanasas (TGasas, EC 2.3.2.13) son una clase de enzimas que catalizan el entrecruzamiento de cadenas peptídicas mediante la formación de enlaces isopéptidos entre los donantes de amina y el grupo γ-carboxiamida de las cadenas laterales de glutamina60 (Figura 5). Aunque la actividad de TGases se observe tanto en el xilema (pared celular cercana a la laminilla media) de plantas resistentes como susceptibles de pimiento a P. capsici, esta es mayor en las resistentes, fortaleciendo la pared celular y evitando que las hifas penetren dichas células (Figura 5)18.
Nitrato reductasa
La enzima nitrato reductasa (NR, EC 1.6.6.1) puede generar óxido nítrico (NO) principalmente a partir de NO-2, jugando un papel en las respuestas de defensa inducidas tanto por PAMPs y mecanismos de gen por gen61. En C. chinense la actividad de NR aumenta constante y progresivamente entre 6 y 72 HPI con P. capsici, incluso en plántulas tratadas con SA y etefón (ET), pudiendo esta respuesta ser relacionada como un mecanismo de defensa específica del huésped (Figura 5)9. Sin embargo, el hallazgo de que P. capsici induce la actividad de NR dependiente de NADH en plantas susceptibles, podría significar que la vía de defensa mediada por el ON podría ser manipulada por el patógeno62. Así, no estaría aun totalmente clara la actividad de esta enzima en plantas de Capsicum.
Regulación de la muerte celular y especies reactivas de oxígeno
La muerte celular o respuesta hipersensible (HR) es una de los principales mecanismos en la defensa vegetal contra patógenos, pero su inducción no siempre es necesaria, de tal manera, varias enzimas se involucran en inducir y mediar la producción de especies reactivas de oxígeno (ROS) i.e. H2O2, O2- y OH-, principales moléculas inductoras de HR49,63. Este metabolismo oxidativo es regulado por un mecanismo enzimático complejo, que incluye NADPH-oxidasa (NOX, EC 1.6.3.1), GPX y lipoxigenasa (LOX, EC 1.13.11.12) como productoras de ROS, y superóxido dismutasa (SOD), APX y catalasa (CAT, EC 1.11.1.6) como captadores46.
Un aumento de la actividad tanto de la enzima LOX como de SOD (dependiente de Calcio – Ca+), puede ser observado en genotipos resistentes de Capsicum como 23CherryP-Orsh a los 7 DPI con P. capsici20,54, siendo de suma importancia dentro de la producción de ROS. Así mismo, NOX puede mediar la muerte celular por peroxidación lipídica, sirviendo además de moléculas de señal. Además, O2- producido por LOX puede fusionarse con el NO formando peroxinitrito (ONOO-), que puede ser tóxico para varios patógenos20,46.
Otra enzima como CAT puede aumentar su actividad en plantas resistentes en comparación a las susceptibles, tanto al inicio de la infección, como hasta los siete DPI con altas concentraciones de inoculo de P. capsici, limitando la excesiva producción de H2O2 y la peroxidación lipídica16. Esto hace que se evite el estrés oxidativo en la planta y la muerte celular innecesaria por la degradación de la membrana plasmática, gracias a la actividad de enzimas como CAT y POX (Figura 5)20,54. La infección causada por patógenos vehiculados por el suelo, puede modificar el metabolismo oxidativo de manera diferente en tejidos de susceptibles y resistentes46.
Fitohormonas
Las fitohormonas son sustancias producidas en las células vegetales que se acumulan en cantidades variables tras el reconocimiento de microbios, dando lugar a la activación de diversos mecanismos de defensa. La resistencia inducida por fitohormonas como SA es más eficaz contra patógenos biótrofos ya que su acción va dirigida a la muerte celular, mientras que la resistencia inducida por ácido jasmónico (JA) y etileno (ET) es generalmente operativa contra el ataque de patógenos necrótrofos, pudiendo incluso servir como moléculas de señalización en la defensa vegetal (Figura 5)64. De hecho, en cultivares resistentes como CM334, la expresión de JA aumenta en hojas hasta alcanzar los 80 mg g-1 a los 30 minutos posterior a la inoculación, alcanzando su nivel máximo a las 24 HPI. Sin embargo, a medida que los niveles de JA disminuyen los niveles de SA aumentan drásticamente, dando paso a una muerte celular mediada también por la producción de H2O2 (Figura 5)65.
De igual forma, ET es otra hormona que estaría correlacionada con la resistencia de Capsicum a P. capsici. Por ejemplo, la aplicación exógena de ET induce resisistencia a P. capsici, 24 horas antes de la infección con el oomiceto, reduciendo los sintomas en hasta un 30%, y aumentando la actividad de PR1, un marcador genético relacionada a la resistencia sistémica adquirida (SAR). Con este se deduce que la planta requiere de ET para activar su defensa vegetal, ya que al bloquear el receptor de la hormona no se manifiesta la resistencia. Así mismo, la acción ET es justificada también por los aumentos o cambios transcripcionales presentados en plantas resistentes, como CaPTI1, conocido como un factor de transcripción de respuesta al ET, involucrado en la expresión de resistencia a P. capsici 66,67
Mecanismos moleculares
Patógenos como P. capsici necesitan inhabilitar los procesos nucleares de defensa del hospedero, provocando alteraciones en el proteoma nuclear. Sin embargo, en plantas resistentes se producen cambios a nivel molecular que inhiben el proceso de infección del patógeno, mediante la activicación de mecanismos como los genes R, que deriva en la síntesis y producción de diferentes compuestos antimicrobianos68,69. Por ejemplo, en pimiento se han descubierto nuevos genes candidatos expresados diferencialmente (DEGs) denominados XLOC, relacionados al transporte de azucares y activación de POX (Figura 5)70.
Líneas resistentes a P. capsici como PI201234 presentan 211 genes candidatos involucrados en respuestas de defensa, que participan en la modificación de la pared celular, la biosíntesis de fitoalexinas, el desarrollo de síntomas y las vías de señalización de fitohormonas71. Además, la resistencia presentada por la línea PI201234 contra la raza 2 de P. capsici podría estar controlada por CaPhyto72. Este y otros hallazgos en PI201234 hace pensar que la resistencia al oomiceto podría ser de tipo horizontal, por conferir inmunidad tanto a la raza 1 como a la 2 de P. capsici73.
Receptores de reconocimiento de patrones
En una interacción compatible de Capsicum – P. capsici, las plantas no activan una eficiente respuesta de defensa, permitiendo al patógeno infectar, colonizar y reproducirse en sus tejidos, y finalmente producir los síntomas característicos. El patógeno hemibiotrofo produce diversos péptidos y moléculas pequeñas conocidas como efectores, que usa para manipular o inhibir las respuestas de defensa del huésped. Uno de esos es el efector SCR82 (proteína rica en cisteína), que en interacciones incompatibles genera un aumento de la agresividad del oomiceto mediante una regulación positiva de ROS74.
Contrariamente, las plantas resistentes (interacciones incompatibles) desarrollan una inmunidad activada por patrones, como los receptores de reconocimiento de patrones (PRR), localizados en la membrana plasmática de las células del huésped i.e. repeticiones ricas en leucina (LRR) y MAPK quinasas, y pueden percibir moléculas extrañas y emitir alertas al interior de la célula, activando diferentes mecanismos de defensa (Figura 5)20. Además, en semillas, raíces, tallos y hojas de Capsicum spp. se han encontrado expresándose genes putativos de quitina inducidos después de la infección de P. capsici, destacándose CaChilV3 y CaChiIV1, que señaliza positivamente la muerte celular y regula la expresión de genes PR (relacionados con la patogénesis), respectivamente (Figura 5)75,76. Estos genes son codificados por proteínas quitinasas que interactúan con la proteína quinasa citoplasmática, similar al receptor CaPIK1 ubicado el retículo endoplásmico (Figura 5). Esta proteína mejora las respuestas a P. capsici i.e. muerte celular, y producción de ROS y NO75. Por otro lado, en Arabidopsis thaliana el efector PcAvr3a12 de P. capsici, es dirigido al retículo endoplásmico para suprimir la expresión de la proteína FKBP15-2 relacionada a la inmunidad vegetal78. Así, se podría inferir que en Capsicum dicho efector podría comprometer la expresión de CaPIK1, afectando la defensa al oomiceto.
Proteínas similares a la calcineurina B (CBL) pueden también interactuar con proteínas quinasas (CIPK). En el genoma de pimiento se han encontrado nueve genes CaCBL y 26 CaCIPK, y su expresión de la mayoría de estos se alteró cuando las plantas estuvieron expuestas a P. capsici. De hecho, la sobreexpresión de CaCIPK1 potencia la acumulación de H2O2 y la muerte celular programada, así como la expresión de genes relacionados con la defensa vegetal (Figura 5)79.
Factores de transcripción
Los factores de transcripción (TFs) son proteínas de unión a ADN específicas y de secuencia, que reconocen elementos específicos en los promotores de genes diana para controlar su expresión ante estímulos exógenos como patógenos, y activar procesos bioquímicos y fisiológicos (Figura 5) en plantas80. Recientemente, se encontró que la inoculación de P. capsici en raíces de pimiento induce la expresión del TFs CanTF (factor de transcripción de C. annuum), regulando a su vez la expresión de genes relacionados con la defensa como CaPR1, CaDEF1 y CaSAR82, y el aumento de la actividad de POX (Figura 5)81.
Familias de multigenes también se desempeñan como TFs, por ejemplo, WRKY. Estos TFs actúan directamente en la resistencia de pimiento contra P. capsici. La expresión de estos genes en las plantas, podrían dividirse en tres subgrupos: respuesta temprana (3 HPI), respuesta media (24 HPI) y respuesta tardia (>24 HPI). El silenciamiento de genes como CaWRKY03-7, CaWRKY06-5 y CaWRKY10-4, aumenta significativamente la susceptibilidad de pimiento a P. capsici, incluso en genotipos resistentes82. Otros TFs como los relacionados a la respuesta al etileno (ERF), así como los genes miembros de la familia APETALA2/ERF, ambos pueden ser inducidos por moléculas de señalización como el SA, JA y H2O2, destacando genes como CaPTI1 y CaAP2/ERF06466,83.
Loci de resistencia
Se conoce que la resistencia en Capsicum spp. contra P. capsici es controlada por numerosos loci en el cromosoma 5, en especial los de rasgos cuantitativos (QTLs)84. Mediante un mapeo de QTLs se determinaron 3 loci (5.1, 5.2, 5.3) que producen los efectos principales de resistencia, logrando identificar 2 genes de dominio Quinasa RLK (PHT81227.1 y PHT81229.1), 2 de unión de nucleótidos y de dominio de repetición ricos en leucina NBS-LRR (PHT81215.1 y PHT81216.1), y uno de la proteína precursora SAR8.2 (S05_28825990), convirtiéndolos en fuertes genes candidatos en la resistencia de Capsicum a P. capsici (Figura 5)85.
En genotipos resistentes de Capsicum a P. capsici como CM334, aparte de los genes tipo NBS (sitio de unión de nucleótidos)-ARC (apoptosis, proteínas R, CED-4), 32 de ellos agrupados en los cromosomas 3, 5 y 7 y exhibiendo respuesta a la infección del oomiceto, también se encontró la presencia del gen Snakin-1 (Figura 5)86. Parece ser que los genes de la proteína NBS-ARC-LRR constituyen la mayoría de genes predominantes de resistencia a enfermedades (genes R).
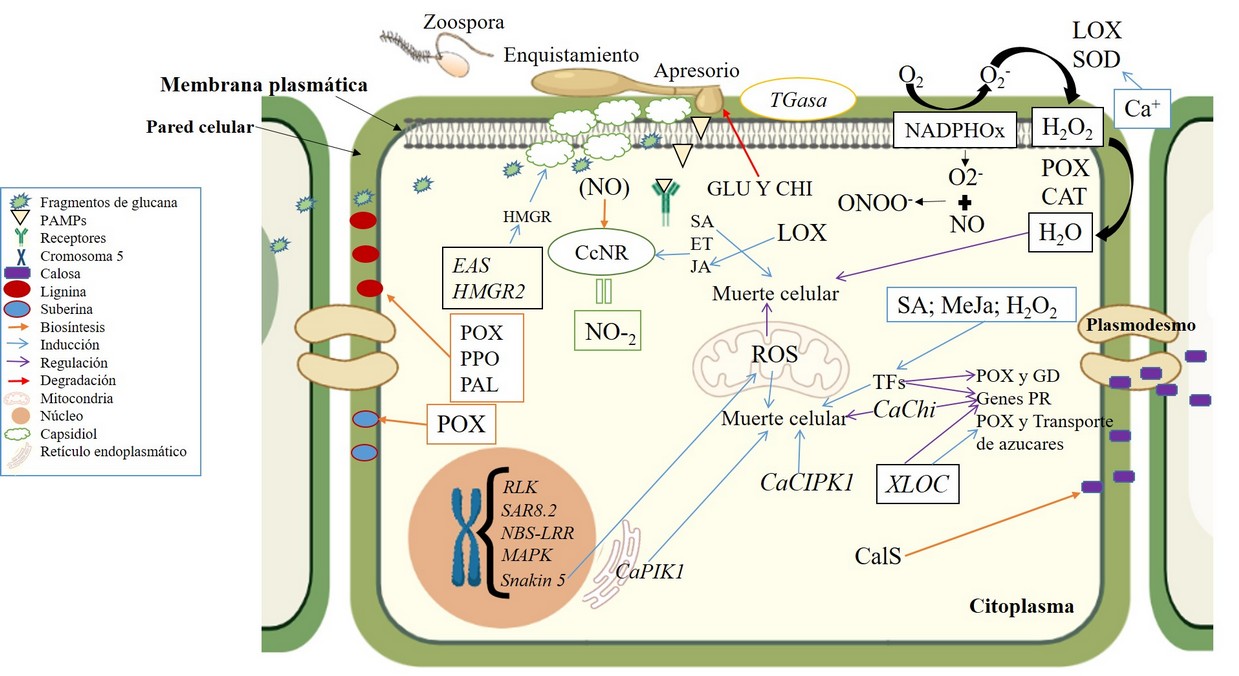
Figure 5. Mecanismos bioquímicos y moleculares de resistencia en Capsicum spp. contra Phytophthora capsici. El reconocimiento de DAMPS por PRRs genera señales mediante DF (ET-JA)64 y genes como CaChiV375, activación de fitoalexinas como Capsidiol40,43 a partir de la enzima HMGR (inducida por genes EAS y HMGR2)41,42, además de la inducción de las enzimas POX48,49, PPO48 y PAL16,53,49,54, involucradas en la biosintesis de compuestos fenólicos que podrían blindar la pared celular, al igual que CalS en la producción de calosa, cuya deposición cercana a los plasmodesmos posibilita la comunicación intercelular18,44. De igual manera TGasa, otra enzima presente en la pared celular que cataliza el entrecruzamiento de cadenas peptídicas mediante la formación de enlaces isopéptidos entre donantes de amina y el grupo γ-carboxiamida de las cadenas laterales de glutamina18,60. GLU y CHI actúan directamente degradando las estructuras del oomiceto como β-1,3-glucanos y quitina, respectivamente, presentes en su pared celular, pudiendo incluso actuar como MAMPs, desencadenando la defensa basal de la planta56,57,59. CcNR inducida por ET y JA, interviene en la biosintesis de nitrógeno, elemento esencial en la defensa vegetal9,62. Producción y regulación de HR por el complejo enzimático NADPHOx, GPX y LOX como productoras de ROS, y SOD, APX y CAT como captadoras o reguladoras46, proceso en el que además se genera ONOO- que es tóxico para varios patógenos20,46. También puede evidenciarce la muerte celular inducida por SA64. TFs pueden regular la actividad POX81, genes PR83, genes de defensa81 y de respuesta al ET66; genes como Snakin-186, genes R de tipo RLK, NBS-LRR y MAPK87,88. La sobre expresión de otros genes como CaPIK175,77 (ubicado en el ER) y CaCIPK1 pueden potenciar la acumulación de H2O278. Así mismo, el gen CaChiV1 regula la muerte celular y la expresión de genes PR74. Finalmente, genes como XLOC actúan tanto en la regulación de la actividad POX, genes PR y el transporte de azucares70.
CONCLUSIONES
Phytophthora capsici es uno de los principales agentes causales de enfermedades en cultivos pertenecientes al género Capsicum alrededor del mundo, especialmente ají y pimiento, debido principalmente a su agresividad (ataca prácticamente todos los tejidos), y poder de diseminación, infección, colonización y reproducción. De tal manera, se ha venido usando genotipos resistentes que poseen diferentes mecanismos de defensa que actúan de manera aislada o conjunta para contrarrestar al oomiceto. Esta revisión explora los principales mecanismos de defensa físicos, bioquímicos (enzimáticos o no), y moleculares que hacen que el patógeno infecte, colonice o se reproduzca lentamente en los tejidos vegetales. A pesar de los avances actuales y recopilados en la presente revisión, aun es amplio el panorama por explorar concerniente al estudio de posibles mecanismos de defensa en genotipos resistentes a P. capsici.
REFERENCIAS
1. Leonian, L. H. (1922). Stem and fruit blight of peppers caused by Phytophthora capsici . Phytopathology 12, 401- 408.
2. Reis, A., Paz-Lima, M., Williams, A., Aguiar, M., Fonseca, M., Café-Filho, A., & Silva, L. (2018). Areappraisal of the natural and experimental host range of Neotropical Phytophthora capsici isolates from Solanaceae, Cucurbitaceae, Rosaceae, and Fabaceae. J. Plant Pathol., 100, 215-223.
3. Saltos, L., Corozo-Quiñones, L., Pacheco-Coello, R., Santos-Ordóñez, E., Monteros-Altamirano, Á., & Garcés-Fiallos, F. R. (2020). Tissue specific colonization of Phytophthora capsici in Capsicum spp.: molecular insights over plant-pathogen interaction. Phytoparasitica, 49, 113-122.
4. Liu, W.‑Y., Kang, J.‑H., Jeong, H.‑S., Choi, H.‑J., Yang, H.‑B., Kim, K.‑T., Choi, D., Choi, G., Jahn, M., & Kang, B.-C. (2014). Combined use of bulked segregant analysis and microarrays reveals SNP markers pinpointing a major QTL for resistance to Phytophthora capsici in pepper. Euphytica, 127, 2503-2513.
5. Gandariasbeitia, M., Ojinaga, M., Orbegozo, E., Ortiz-Barredo, A., Núñez-Zofío, M., Mendarte, S., & Larregla, S. (2019). Winter biodisinfestation with Brassica green manure is a promising management strategy for Phytophthora capsici control of protected pepper crops in humid temperate climate regions of northern Spain. Span. J. Agric.l Res., 17, 1-11.
6. Barchenger, D., Lamour, K., & Bosland, P. (2018). Desafíos y estrategias para mejorar la resistencia en Capsicum annuum al patógeno múltiple, Phytophthora capsici. Front. Plant Sci., 9, 1-16.
7. Hung-Wan, J., & Liew, E. (2020). Efficacy of chemical and biological agents against pepper blight (Phytophthora capsici Leonion) in East Asia: a meta-analysis of laboratory and field trial data. Inter. J. Plant Pathol., 102, 835-842.
8. Dum, A., & Smart, C. (2015). Interactions of Phytophthora capsici with resistant and susceptible pepper roots and stems. Phytopathology, 105, 1355-1361.
9. Caamal-Chan, M., Souza-Perera, R., & Zúñiga-Aguilar, J. (2011). Systemic induction of a Capsicum chinense nitrate reductase by the infection with Phytophthora capsici and defence phytohormones. Plant Physiol. Biochem., 49, 1238-1243.
10. Lamour, K., Stam, R., Jupe, J., & Huitema, E. (2012). The oomycete broad-host-range pathogen Phytophthora capsici. Mol. Plant Pathol., 13, 329-337.
11. Retes-Manjarrez, J., Rubio-Aragón, W., Márques-Zequera, I., Cruz-Lachica, I., García-Estrada, R., & Sy, O. (2020). Novel Sources of Resistance to Phytophthora capsici on Pepper (Capsicum sp.) Landraces from Mexico. Plant Pathol. J., 36, 600-607.
12. Stam, R., Howden, A., Delgado-Cerezo, M., Amaro, T., Motion, G., Pham, J., & Huitema, E. (2013). Characterization of cell death inducing Phytophthora capsici CRN effectors suggests diverse activities in the host nucleus. Front. Plant Sci., 4, 1-11.
13. Stam, R., Jupe, J., Howden, A., Morris, J., Boevink, P., Hedley, P., & Huitema, E. (2013). Identification and Characterisation CRN Effectors in Phytophthora capsici Shows Modularity and Functional Diversity. PloS One, 8, 1-13.
14. Lizzi, Y., Roggero, J., & Coulomb, P. (1995). Behaviour of the Phenolic Compounds on Capsicum annuum Leaves Infected with Phytophthora capsici. J. Phytopathol., 143, 619-627.
15. Egea, C., Alcazar, D., & Candela, E. (1996). Capsidiol: Its role ie the resistance of Capsicum annuum to Phytophthora capsici. Physiol. Plant., 98, 737-742.
16. Koc, E., Sülün, A., Islek, C., & Kasko, Y. (2011). Defence responses in leaves of resistant and susceptible pepper (Capsicum annuum L.) cultivars infected with different inoculum concentrations of Phytophthora capsici Leon. Sci. Hortic., 128, 434-442.
17. Kim, S., & Kim, Y. (2009). Histological and cytological changes associated with susceptible and resistant responses of chili pepper root and stem to Phytophthora capsici infection. Plant Pathol. J., 25, 113-120.
18. Piccini, C., Parrotta, L., Faleri, C., Romi, M., Del Duca, S., & Cai, G. (2019). Histomolecular responses in susceptible and resistant phenotypes of Capsicum annuum L. infected with Phytophthora capsici. Sci. Hortic., 244, 122-133.
19. Castro, O., Fernandez, S., & Osuna , P. (2012). Mecanismos de defensa del Chile en el Patosistema Capsicum annuum-Phytophthora capsici. Rev. Mex. fitopatol., 30, 49-65.
20. Chávez-Díaz, I., y Zavaleta-Mejía, E. (2019). Comunicación molecular en el sistema Capsicum spp.-Phytophthora capsici. Rev. Mex. fitopatol., 37, 251-278.
21. Blair, J., Coffey, M., Park, S., Geiser, D., & Kang, S. (2008). A multi-locus phylogeny for Phytophthora utilizing markers derived from complete genome sequences. Fungal Genet. Biol., 45 , 266–277.
22. Ho, H. H. (2018). The taxonomy and biology of Phytophthora and Pythium. J. Bacteriol. Mycol.: Open Access, 6, 40-45.
23. Ortiz, E., & Camargo, L. (2005). Doenças da Nogueira Pecan . En H. Kimati, L. Amorin, A. Bergamin, L. Camargo, & J. Rezende, Manual de Fitopatologia (págs. 530-535). São Paulo: Agronômica Ceres Ltda.
24. Ristaino, J. (1991). Influence of rainfall, drip irrigation, and inoculum density on the development of Phytophthora root and crown rot epidemics and yield in bell pepper . Phytopathology, 81 , 922-929.
25. Lamour, K. H., & Hausbeck, M. K. (2004). Phytophthora capsici on vegetable crops: esearch progress and managament challenges. Plant Dis, 88, 1292-1303.
26. Soto-Plancarte, A., Fernández-Pavía, S., Rodríguez-Alvarado, G., LópezPérez, Fernández-Pavía, Y., Pedraza-Santos, M., & Álvarez-Vargas, J. (2018). Phytophthora capsici and P. drechsleri mating types A1 and A2 coexist in ornamental nursery plants. Mex. J. Phytopathol., 36, 298-307.
27. Esfahani, M., Nasehi, A., Rahmanshirazi, P., Ghadirian, H., & Ashtiani, F. (2014). Susceptibility assessment of bell pepper genotypes to crown and root rot disease. Arch. Phytopathol. Pflanzenschutz, 47, 944–953.
28. Granke, L., Quesada-Ocampo, L., Lamour, K., & Hausbeck, M. (2012). Advances in Research on Phytophthora capsici on Vegetable Crops in The United States . Plant Dis., 95 , 1588-1600.
29. Majid, M., Awan, M., Fatima, K., Tahir, M., Ali, Q., Rashind, B., Rao, A., Nasir, I., & Husnain, T. (2016). Phytophthora capsici on chilli pepper (Capsicum annuum L.) and its management through genetic and bio-control: a review . Zemdirbyste., 103 , 419-430.
30. Cheng, W., Lin, M., Qiu, M., Kong, L., Xu, Y., Li, Y., & Wang, Y. (2019). Chitin synthase is involved in vegetative growth, asexual reproduction and pathogenesis of Phytophthora capsici and Phytophthora sojae. Environ. Microbiol. , 1-11.
31. Chen, X.-R., Ye, Z., Li, H.-Y., Zhang, Z.-H., Sheng, G.-L., Li, Y.-P., Xing, Y.-P., Huang, S.-X., Tao, H., Kuan, T., Zhai, Y., & Ma, W. (2019). The RXLR effector PcAvh1 is required for full virulence of Phytophthora capsici. Mol. Plant. Microbe. Interact., 32, 986-1000.
32. Li, Q., Wang, J., Bai, T., Zhang, M., Jia, Y., Shen, D., Zhang, M., & Dou, D., (2019). A Phytophthora capsici effector suppresses plant immunity via interaction with EDS1. Mol. Plant Pathol., 1-10.
33. Li, Q., Chen, Y., Wang, J., Zou, F., Jia, Y., Shen, D., Zhang, Q., Jin, M., Dou, D., & Zhang, M. (2019). A Phytophthora capsici virulence effector associates with NPR1 and suppresses plant immune responses. Phytopathol. Res., 1, 1-11.
34. Tafolla-Arellano, J., González-León, A., Tiznado-Hernández, M., Zacarías, L., & Báez-Sañudo, R. (2013). Composición, fisiología y biosintesis de la cutícula ne plantas. Rev. Fitotec. Mex., 36, 3-12.
35. Serrano, M., Coluccia, F., Torres, M., L’Haridon, F., & Métraux, J.-P. (2014). The cuticle and plant defense to pathogens. Front. plant sci., 5, 1-8.
36. Lee, Y., Hong, J., Sanwald, S., & Hwang, B. (2000). Histological and ultrastructural comparisons of compatible, incompatible and -β-amino- n -butyric acid-induced resistance responses of pepper stems to Phytophthora capsici. Physiol. Mol. Plant Pathol., 57 , 269-280.
37. Biles, C., Wall, M., & Palmer, H. (1993). Relationship of Phytophthora Fruit Rot to Fruit Maturation and Cuticle Thickness of New Mexican-type Peppers. Phytopathology, 83, 607-611.
38. Alzohairy, S., Hammerschmidt, R., & Hausbeck, M. (2020). Changes in Winter Squash Fruit Exocarp Structure Associated with Age-Related Resistance to Phytophthora capsici. Phytopathology, 110, 447-455.
39. Passardi, F., Cosio, C., Penel, C., & Dunand, C. (2005). Peroxidases have more functions than a Swiss army knife. Plant Cell Rep., 24, 65-255.
40. Stoessl, A., Unwin, C., & Ward, E. (1972). Capsidiol, an antifungal compound from Capsicum frutescens. J. Phytopathol., 74, 141-152.
41. Villar- Luna, E., Rojas-Martinez, R., Reyes-Trejo, B., Gomez-Rodriguez, O., & Zavaleta-Mejia, E. (2017). Mevalonate pathway genes expressed in chilli CM334 inoculated with Phytophthora capsici and infected by Nacobbus aberrans and Meloidogyne enterolobii. Eur. J. Plant. Pathol., 168, 867–881.
42. Song, N., Ma, L., Wang, W., Sun, H., Wang, L., Baldwin, I. T., & Wu, J. (2019). An ERF2-like transcription factor regulates production of the defense sesquiterpene capsidiol upon Alternaria alternata infection. J. Exp. Bot., 70, 5895-5908.
43. Arreola-Cortés, A., Castro-Mercado, E., Lozoya-Gloria, E., & García-Pineda, E. (2007). Capsidiol production in pepper fruits (Capsicum annuum L.) induced by arachidonic acid is dependent of an oxidative burst. Physiol. Mol. Plant Pathol., 70, 69–76.
44. Zavaliev, R., Ueki, S., & Epel, B. (2011). Biology of callose (β-1,3-glucan) turnover at plasmodesmata. Protoplasma, 248, 117-130.
45. Lorrai, R., & Ferrari, S. (2021). Host Cell Wall Damage during Pathogen Infection: Mechanisms of Perception and Role in Plant-Pathogen Interactions. Plants, 10, 1-20.
46. De Quadros, F., Garcés-Fiallos, F., De Freitas, M., Bouzon, Z., Barcelos-Oliveiras, J., Stadnik, M. (2021). Dual role of H2O2 in late stages of root colonization of resistant and susceptible bean plants by Fusarium oxysporum f. sp. phaseoli. Physiol. Mol. Plant Patol., 115, 1-8.
47. Mathé, C., Barre, A., Jourda, C., & Dunand, C. (2010). Evolution and expression of class III peroxidases. Arch. Biochem. Biophys., 500, 58-65.
48. Jung, W.-J., Jin, Y.-L., Kim, Y.-C., Kim, K.-Y., Park, R.-D., & Kim, T.-H. (2004). Inoculation of Paenibacillus illinoisensis alleviates root mortality activates of lignification-related enzymes, and induction of the isozymes in pepper plants infected by Phytophthora capsici. Biol. Control, 30, 645-652.
49. Koc, E., & Sülün, A. (2012). Influence of Phytophthora capsici L. inoculation on disease severity, necrosis length, peroxidase and catalase activity and phenolic content of resistant and susceptible pepper (Capsicum annuum L.) plants. Turk. J. Biol., 36, 357-371.
50. Selvarajan, E., Veena, R., & Manoj, N. (2018). Polyphenol Oxidase, Beyond Enzyme Browning. En J. Singh, D. Sharma, G. Kumar, & N. Sharma, Microbial Bioprospecting for Sustainable Development (págs. 203-222). Singapore: Springer.
51. Garcés‑Fiallos, F., de Quadros, F., Ferreira, C., de Borba, M., Bouzon, Z., Barcelos‑Oliveira, J., & Stadnik, M. (2021). Changes in xylem morphology and activity of defense-related enzymes are associated with bean resistance during Fusarium oxysporum colonization. Protoplasma, 1-13.
52. Mandal, S., & Mitra, A. (2007 ). Reinforcement of cell wall in roots of Lycopersicon esculentum through induction of phenolic compounds and lignin by elicitors. Physiol. Mol. Plant Pathol., 71, 201–209.
53. Li, Y., Yu, T., Wu, T., Wang, R., Wang, H., Du, H., Xu, X., Xie, D., & Xu, X.M. (2020). The dynamic transcriptome of pepper (Capsicum annuum) whole roots reveals an important role for the phenylpropanoid biosynthesis pathway in root resistance to Phytophthora capsici. Gene, 728, 144-288.
54. Mohammadbagheri, L., Nasr-Esfahani, M., Abdossi, V., & Naderi, D. (2021). Genetic diversity and biochemical analysis of Capsicum annuum (Bell pepper) in response to root and basal rot disease, Phytophthora capsici. Phytochemistry, 190, 1-10
55. Nakazawa-Ueji, Y., Núñez-Pastrana, R., Souza-Perera, R., Santana-Buzzy, N., & Zúñiga-Aguilar, J. (2010). Mycelium homogenates from a virulent strain of Phytophthora capsici promote a defence-related response in cell suspensions from Capsicum chinense. Eur. J. Plant Pathol., 126, 403-415.
56. Zhang, Y., Li, D., Gong, Z., Wang, J., Yin, Y., & Ji, J. (2013). Genetic determinants of the defense response of resistant and susceptible pepper (Capsicum annuum) cultivars infected with Phytophthora capsici (Oomycetes; Pythiaceae). Genet. Mol. Res., 12 , 3605-3621 .
57. Robinson, S., & Bostock, R. (2015). β-glucans and eicosapolyenoic acids as MAMPs in plant–oomycete interactions: past and present. Front. Plant Sci., 5, 1-11.
58. Egea, C., Dickinson, M., Candela, M., & Emilia, C. M. (1999). b-1,3-Glucanase isoenzymes and genes in resistant and susceptible pepper (Capsicum annuum) cultivars infected with Phytophthora capsici. Physiologia Plantarum, 107, 312–318.
59. Liu, Z., Shi, L., Yang, S., Lin, Y., Weng, Y., Hussain, A., Noman, A., & He, S. (2017). Functional and Promoter Analysis of ChiIV3, a Chitinase of Pepper Plant, in Response to Phytophthora capsici Infection. Inter. J. Mol. Sci., 18, 1-17.
60. Montavon, T., & Bruner, S. (2010). Nonribosomal Peptide Synthetases. En T. Montavon, & S. Bruner, Nonribosomal Peptide Synthetases (págs. 619-655). Gainesville: Elsevier Ltd.
61. Mur, L., Simpson, C., Kumari, A., Gupta, A., & Gupta, K. (2016). Moving nitrogen to the centre of plant defence against pathogens. Ann. Bot., 119, 703-709.
62. Caamal-Chan, M., Nakazawa-Ueji, Y., Souza, R., & Zúñiga, J. (2018). La regulación molecular de las respuestas de defensa del chile habanero contra microorganismos patógenos. En T. González, F. Vázquez, & J. Zúñiga, Mejoramiento genético del chile habanero de la Península de Yucatán (págs. 189- 196). Meridaa: CICY (Centro de Investigación Científica de Yucatán).
63. Anjum, N., Sharma, P., Gill, S., Hasanuzzaman, M., Khan, E., Kachhap, K., Mohamed, A., Thangavel, P., Devi, G., Vasudhevan, P., Sofo, A., Khan, N., Misra, A., Lukatkin, A., Singh, H., Pereira, E., & Tuteja, N. (2016). Catalase and ascorbate peroxidase representative H2O2 detoxifying heme enzymes in plants. Environ. Sci. Pollut. Res., 23 , 19002–19029.
64. Mhlongo, M., Piater, L., Steenkamp, P., Labuschagne, N., & Dubery, I. (2021). Metabolomic Evaluation of Tissue-Specific Defense Responses in Tomato Plants Modulated by PGPR-Priming against Phytophthora capsici Infection. Plants, 10, 2-22.
65. Ueeda, M., Kubota, M., & Nishi, K. (2006). Contribution of jasmonic acid to resistance against Phytophthora blight in Capsicum annuum cv. SCM334. Physiol. Mol. Plant Pathol ., 67, 149-154.
66. Núñez-Pastrana, R., Fabiola Arcos-Ortega, G., Souza-Perera, R., Sánchez-Borges, C., Nakazawa-Ueji, Y., García-Villalobos, F., Guzmán-Antonio, A., & Zúñiga-Aguilar, J. (2011). Ethylene, but not salicylic acid or methyl jasmonate, induces a resistance response against Phytophthora capsici in Habanero pepper. Eur. J. Plant. Pathol., 131 , 669–683.
67. Jin, J.-H., Zhang, H.-X., Tan, J.-Y., Yan, M.-J., Li, D.-W., Khan, A., & Gong, Z.-H. (2016). A New Ethylene-Responsive Factor CaPTI1 Gene of Pepper (Capsicum annuum L.) Involved in the Regulation of Defense Response to Phytophthora capsici. Front. Plant Sci., 6, 1-12.
68. Howden, A., Stam, R., Martinez, V., Motion, G., Have, S., Hodge, K., Marqués, T., & Huitema, E. (2017). Quantitative analysis of the tomato nuclear proteome during Phytophthora capsici infection unveils regulators of immunity. New Phytol., 215, 309-322.
69. Serrano-Jamaica, L., Villordo-Pineda, E., González-Chavira, M., Guevara-González, R., & Medina-Ramos, G. (2021). Effect of Fragmented DNA From Plant Pathogens on the Protection Against Wilt and Root Rot of Capsicum annuum L. Plants. Front. Plant Sci., 11, 1-13.
70. Bagheri, L., Nasr-Esfahani, M., Abdossi, V., & Naderi, D. (2020). Analysis of candidate genes expression associated with defense responses to root and collar rot disease caused by Phytophthora capsici in peppers Capsicum annuum. Genomics, 112, 2309–2317.
71. Wang, P., Liu, X., Guo, J., Liu, C., Fu, N., & Shen, H. (2015). Identification and Expression Analysis of Candidate Genes Associated with Defense Responses to Phytophthora capsici in Pepper Line “PI 201234”. Inter. J. Mol. Sci., 16, 11417-11438.
72. Wang, P., Wang, L. G., Yang, W., & Shen, H. (2016). Molecular mapping of a gene conferring resistance to Phytophthora capsici Leonian race 2 in pepper line PI201234 (Capsicum annuum L.). Mol. Breeding, 36, 1-11.
73. Bartual, R., Marsal, J., Carbonell, E., Tello, J., & Campos, T. (1991). Genética de la resistencia a Phytophthora capsici LEÓN en pimiento. Bol. San. Veg. Plagas, 17 , 3-124.
74. Zhang, Z., Jin, J., Sheng, G., Xing, Y., Liu, W., Zhou, X., Liu, Y., & Chen X. (2021). A small cysteine-rich phytotoxic protein of Phytophthora capsici functions as both plant defense elicitor and virulence factor. Mol. Plant-Microbe Interact. 1-13.
75. Ali, M., Gai, W.‑X., Khattak, A., Khan, A., Haq, S., Ma, X., Wei, A.-M., Muhammad, I., Jan, I., & Gong, Z.‑H. (2019). Knockdown of the chitin-binding protein family gene CaChiIV1 increased sensitivity to Phytophthora capsici and drought stress in pepper plants. Mol. Genet. Genom., 294, 1311–1326.
76. Ali, M., Luo, D.-X., Khan, A., Haq, S., Gai, W.-X., Zhang, H.-X., Cheng, G.-X., Muhammad, I., & Gong, Z.-H. (2018). Classification and Genome-Wide Analysis of Chitin-Binding Proteins Gene Family in Pepper (Capsicum annuum L.) and Transcriptional Regulation to Phytophthora capsici, Abiotic Stresses and Hormonal Applications. Int. J. Mol. Sci., 19, 1-25.
77. Sung, D., Hyun, N., & Kook, B. (2015). The Capsicum annuum class IV chitinase ChitIV interacts with receptor-like cytoplasmic protein kinase PIK1 to accelerate PIK1-triggered cell death and defence responses. J. Exp. Bot., 66, 1987-1999 .
78. Fan, G., Yang, Y., Li, T., Lu, W., Du, Y., Qiang, X., Wen, Q. & Shan, W. (2018). A Phytophthora capsici RXLR Effector Targets and Inhibits a Plant PPIase to Suppress Endoplasmic Reticulum-Mediated Immunity. Mol. Plant, 11, 1067-1083.
79. Ma, X., Gai, W.-X., Qiao, Y.-M., Ali, M., Wei, A.-M., Luo, D.-X., Li, Q.-H., & Gong, Z.-H. (2019). Identification of CBL and CIPK gene families and functional characterization of CaCIPK1 under Phytophthora capsici in pepper (Capsicum annuum L.). BMC Genomics, 20, 1-18.
80. Liu, L., White, M., & MacRae, T. (1999). Transcription factors and their genes in higher plants Functional domains, evolution and regulation. Eur. J. Biochem., 262, 247-257.
81. He, Y.-M., Luo, D.-X., Khan, A., Liu, K.-K., Arisha, M., Zhang, H.-X., & Cheng, G.-X. X.-H. (2018). CanTF, a novel transcription factor in pepper, is involved in resistance to Phytophthora capsici as well as abiotic stresses. Plant Mol. Biol. Rep., 36, 776-789.
82. Cheng, W., Jiang, Y., Peng, J., Guo, J., Lin, M., Jin, C., Huang, J., Tang, W., Guan, D., & He, S. (2020). The transcriptional reprograming and functional identification of WRKY family members in pepper’s response to Phytophthora capsici infection. BMC Plant. Biol.y, 20, 1-14.
83. Jin, J.-H., Zhang, H.-X., Ali, M., Wei, A.-M., Luo, D.-X., & Gong, Z.-H. (2019). The CaAP2/ERF064 Regulates Dual Functions in Pepper: Plant Cell Death and Resistance to Phytophthora capsici. Genes, 10 , 1-15.
84. Kim, N., Kang, W.-H., Lee, J., & Yeom, S.-I. (2019). Development of clustered resistance gene analogs-based markers of resistance to Phytophthora capsici in chili pepper. BioMed Res. Inter.l, 2019, 1-12.
85. Siddique, M., Lee, H.-Y., Ro, N.-Y., Han, K., Venkatesh, J., Solomon, A., Patil, A., Changkwian, A., Kwon, J.-K., & Kang, B.-C. (2019). Identifying candidate genes for Phytophthora capsici resistance in pepper (Capsicum annuum) via genotyping-by-sequencing-based QTL mapping and genome-wide association study. Sci. Rep., 9, 1-15.
86. Du, J.-S., Hang, L.-F., Hao, Q., Yang, H.-T., Ali, S., Ezaat, R., Xu, X.-Y., Tan, H.-Q., Su, L.-H., Li, H.-X., Zou, K.-X., Li, Y., Sun, B., Lin, L.-J., & Lai, Y.-S. (2021). The dissection of R genes and locus Pc5.1 in Phytophthora capsici infection provides a novel view of disease resistance in peppers. BMC Genomics, 22, 1-16.
Received: 8 December 2021 / Accepted: 25 January 2022 / Published:15 May 2022
Citation: Gaibor-Vaca D; García-Bazurto G ; Garcés-Fiallos F . Mecanismos de defensa en plantas de Capsicum contra Phytophthora capsici. Revis Bionatura 2022;7(2) 25. http://dx.doi.org/10.21931/RB/2022.07.02.25
